氧化还原反应中化合价尽量不变规律
时间:2015-05-26 19:48 来源: 作者:黄元 点击:次 所属专题: 化合价 氧化还原反应规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
歧化反应刚好与归中反应相反,一种元素的化合价向两边散开,不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象。——归中反应规律价态归中是指,高价态的化合价降低,低价态的化合价升高,但不可能低价态的元素最后升的比原来高价态化合价还高。
归中现象:1、氧化还原反应中的归中反应:含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应。发生归中反应的条件是要符合中间价态理论:含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应。而且高低价态变化的结果是生成该元素的中间价态。
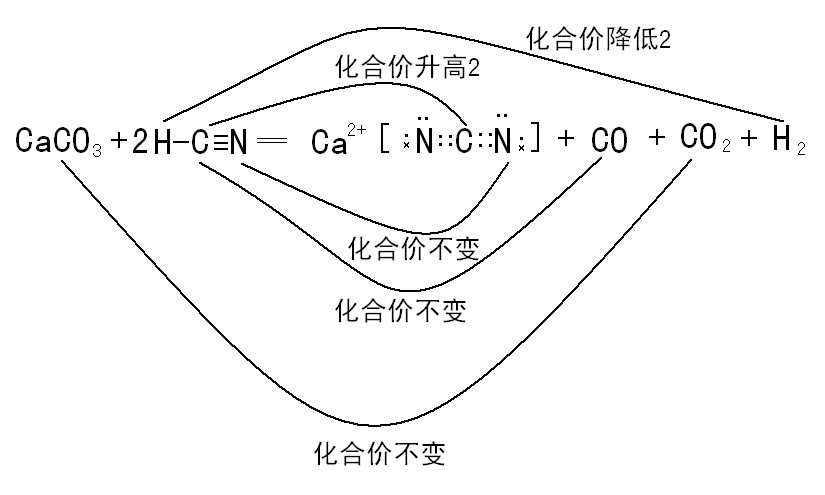
依据以上规律,总结一句话,化合价在氧化还原反应中,尽量不变,假如要变化,尽量变化小。
1、C+CO2=2CO
2、SO2+2H2S=3S↓+2H2O
3、H2SO3+2H2S=3S↓+3H2O
4、H2S+3H2SO4(浓)=4SO2+4H2O
5、3H2S+H2SO4(浓)=4S+4H2O
6、H2S+H2SO4(浓)——SO2+S+4H2O(多种情况,就近原则)
7、2Fe3++Fe=3Fe2+
8、6HCl+KClO3=KCl+3Cl2↑+3H2O(KCl中的Cl来自盐酸)
9、5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
10、Ca(ClO)2+4HCl(浓)=2Cl2↑+CaCl2+2H2O(CaCl2中的Cl来自盐酸)
11、Ca(ClO3)2+12HCl(浓)=2Cl2↑+CaCl2+6H2O(CaCl2中的Cl来自盐酸)
12、CuO+Cu=Cu2O
13、2Na+Na2O2=2Na2O
14、5NaI+NaIO3+3H2SO4=3I2+3Na2SO4+3H2O
15、NO2+NO+2NaOH -=2NaNO2+H2O
16、NaH+H2O=NaOH+H2
17、NaH+HCl=NaCl+H2
18、2NaClO3+4HCl==2ClO2↑+Cl2↑+ 2NaCl + 2H2O(就近原则)
19、Cu(IO3)2+24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O(CuI中的I来自KI)

- 全部评论(0)
