某些水解为什么能“进行到底”
时间:2015-06-09 22:43 来源: 作者:袁建标 点击:次 所属专题: 双水解反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.水解平衡常数小,无法进行到底
例1.关于醋酸铵溶液——不能进行到底
Ac- + H2O = HAc + OH- NH4+ + H2O = NH3·H2O + H+
由于生成的H+和OH-会结合生成水,所以促进醋酸铵的水解,两式相加得醋酸铵总的水解方程:
Ac- + NH4+ + H2O = HAc + NH3·H2O
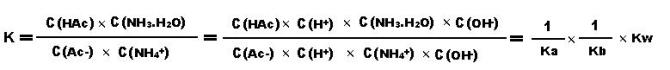
已知Ka=1.75×10-5 Kb=1.8×10-5 Kw=10-14所以醋酸铵的水解平衡常数约为3.2×10-5,属于部分水解,通过计算,可以认为水解程度不很大。无法进行到底。
例2.同理(NH4)2CO3的水解常数应该为K=Kw÷Kb÷Ka2
已知Ka2=5.6×10-11 Kb=1.8×10-5 Kw=10-14
所以碳酸铵的水解平衡常数为K=103,假如碳酸铵溶液的浓度为0.1mol L,通过计算,碳酸铵大约90%水解,但是由于此时水解并没有得到碳酸,而得到碳酸的第二次水解常数要小得多,其平衡常数只有前者的万分之一,完全可以忽略不计。
二.水解平衡常数很大,水解进行到底
例1.关于铝离子和碳酸氢根离子离子的双水解——能进行到底。
很容易得到这两种离子发生双水解的平衡常数K=K3w÷Ksp(氢氧化铝) ÷K3a(碳酸的一级电离常数,注:碳酸的二级电离常数更小,计算结果,水解常数更大,但要进行二级水解才可以得到碳酸,然后分解)
已知:Ksp(氢氧化铝) =3.2×10-34 Ka=4.3×10-7 Kw=10-14
计算得到它们的水解平衡常数K≈4.0×1010,很容易看出,其平衡常数很大,水解程度很大,完全可以水解到底得到高浓度的碳酸以及氢氧化铝沉淀。
例2.乙醇钠和水反应——能进行到底。
把乙醇钠和水混合后,我们先来考查该体系中的平衡问题。显然,这里存在H2O  H++ OH-以及CH3CH2OH
H++ OH-以及CH3CH2OH  H++ CH3CH2O-
H++ CH3CH2O-
因此这里存在的水解平衡为:CH3CH2O-+HOH  CH3CH2OH + OH-
CH3CH2OH + OH-
笔者查到乙醇的电离常数K=8.0×10-20,水的电离常数为Kw=1.0×10-14)
所以该平衡的电离常数K=Kw÷K(乙醇)≈1.25×105,常数很大。
所以我们认为乙醇钠水溶液不存在,可以认为完全水解。
例3.过氧化钠钠和水反应——能进行到底。
把过氧化钠和水混合后,我们先来考查该体系中的平衡问题。显然,这里存在H2O  H++ OH-以及H2O2
H++ OH-以及H2O2 H++ HO2- ;;H2O-
H++ HO2- ;;H2O- H++ O22-
H++ O22-
所以该平衡的电离常数K=Kw÷K(双氧水)【这里采用双氧水的一级电离常数即可,因为二级电离常数更小,计算得到的水解常数更大),查找得到双氧水的电离常数为K1=1.55×10-12,K2==1×10-25
计算得到过氧化钠的水解平衡常数K≈0.01,常数不是很大,但由于其二级水解的平衡常数约为1011,因此过氧化钠在水中也能完全水解。在碳酸或盐酸中则更容易发生反应,也因为双氧水本身为液体,因此水解以后,不会所有的双氧水分解,则就可以解释为什么把过氧化钠放入滴有酚酞的水中,可以看到溶液先变红,又褪色的精确思考。
三.其他一些物质的类似情况
1、氮化镁水解
2、电石水解
3、碳化铝水解
4、五氯化磷和三氯化磷的水解
5、铁离子和碳酸根离子、碳酸氢根离子、偏铝酸根离子双水解
6、铝离子和碳酸根离子、碳酸氢根离子、偏铝酸根离子。
7、偏铝酸根离子和铵根离子。
8、偏铝酸根离子和碳酸氢根离子(电离和水解)

- 全部评论(0)
