常见气体物质的除杂方法
时间:2015-12-26 16:53 来源:未知 作者:王兵 点击:次 所属专题: 除杂
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
气体除杂常用的装置如下:
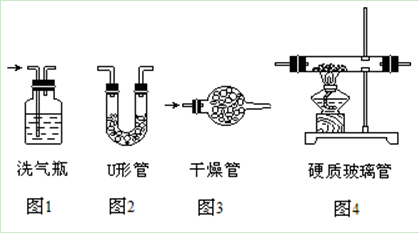
(1)N2(O2)
方法:通过盛有足量灼热Cu丝的硬质玻璃管(装置—图4)。
原理:2Cu+O2  2CuO。
2CuO。
(2)CO(CO2)
方法:通过盛有NaOH溶液的洗气瓶(装置—图1)。
原理:CO2+2NaOH=Na2CO3+H2O
(3)CO2 (CO)
方法:通过盛有灼热的CuO的硬质玻璃管(装置—图4)。
原理:CuO+CO  Cu+CO2
Cu+CO2
(4)CO2 (HCl)
方法:通过盛有饱和NaHCO3溶液的洗气瓶(装置—图1)。
原理:NaHCO3+HCl=NaCl+CO2↑+H2O
方法:依次通过盛有饱和食盐水和浓硫酸的洗气瓶(装置—图1)。
原理:HCl在水中的溶解度很大(1:500),饱和食盐水的水就能将氯化氢溶解除去,浓硫酸具有吸水性,能够除去水蒸气。
(6)NH3(H2O)
方法:通过盛有碱石灰的干燥管或U形管(装置—图3或图2)。
原理:碱石灰是碱性干燥剂,可吸收氨气中的水蒸气。
(7)SO2(HCl、H2O)
方法:依次通过盛有饱和NaHSO3溶液和浓硫酸的洗气瓶(装置—图1)。
原理:NaHSO3+HCl=NaCl+SO2↑+H2O,二氧化硫与浓硫酸不反应,可以用浓硫酸吸收二氧化硫中的水蒸气。
(8)除去CO2中的少量SO2的方法
方法:通过盛有饱和NaHCO3溶液或酸性KMnO4溶液 或溴水的洗气瓶(装置—图1)。
原理:2NaHCO3+SO2=Na2SO3+2CO2↑+H2O,2KMnO4+5SO2+2H2O == 2MnsO4+K2SO4+2H2SO4,SO2+Br2+2H2O=H2SO4+2HBr。
注意:气体物质中的杂质不能用通入气体与杂质反应的方法来除杂,如除去CO2 中含有的少量CO,如果采用通入氧气点燃的方法是错误的,因为气体的用量很难控制适量,氧气不足,CO除不尽,氧气过量,会产生新的杂质,且在有大量二氧化碳的情况下,很难点燃气体。

- 全部评论(0)
