金属键的能带理论
时间:2016-04-19 12:06 来源:未知 作者:杨董 点击:次 所属专题: 金属键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
金属键的另一种理论是能带理论。能带理论是分子轨道理论的扩展,要点有:
(1)原子单独存在时的能级(1s、2s、2p……)在n个原子构成的一块金属中形成相应的能带(1s、2s、2p……);一个能带就是一组能量十分接近的分子轨道,其总数等于构成能带的相应原子轨道的总和,例如,金属钠的3s能带是由n个钠原子的n个3s轨道构成的n个分子轨道。通常n是一个很大的数值(不难由金属块的体积、密度和原子量估算出来),而能带宽度一般不大于2 eV,将能带宽度除以n,就得出能带中分子轨道的能量差,这当然是一个很小的数值,因此可认为能带中的分子轨道在能量上是连续的,参见图3-12。
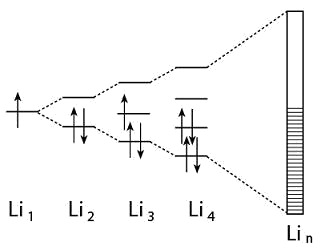
图3-12金属晶体中的能带模型
图3-12表明:一个锂原子有1个2s轨道,2个锂原子有2个2s轨道建造的2个分子轨道,3个锂原子有3个2s轨道建立的3个分子轨道……n个锂原子有n个2s轨道建立的n个连续的分子轨道构成的2s能带。
能带宽度与许多因素有关,它与原子之间的距离有关,也与构成能带的原子轨道的轨道能大小有关。随原子距离渐进,能带变宽,当金属中的原子处于平衡位置,各能带具有一定宽度;原子轨道能大(即外层轨道),能带宽度大;原子轨道能小(即内层轨道),能带宽度小。另外,温度也影响能带宽度。
(2)按能带填充电子的情况不同,可把能带分为满带(又叫价带)、空带和导带三类——满带中的所有分子轨道全部充满电子;空带中的分子轨道全都没有电子;导带中的分子轨道部分地充满电子。例如,金属钠中的1s、2s、2p能带是满带,3s能带是导带,3p能带是空带。换言之,金属键在本质上是一种离域键,形成金属键的电子遍布整个金属,但其能量不是任意的,因而它们并非完全自由,而是处在具有一定能量宽度的能带中。
(3)能带与能带之间存在能量的间隙,简称带隙,又叫“禁带宽度”。有3类不同的带隙:带隙很大、带隙不大、没有带隙(即相邻两能带在能量上是重叠的)。
(4)能带理论对金属导电的解释如下。第一种情况:金属具有部分充满电子的能带,即导带,在外电场作用下,导带中的电子受激,能量升高,进入同一能带的空轨道,沿电场的正极方向移动,同时,导带中原先充满电子的分子轨道因失去电子形成带正电的空穴,沿电场的负极方向移动,引起导电。如金属钠的导电便属于此情况,因为它的3s能带是半充满的导带。第二种情况:金属的满带与空带或者满带与导带之间没有带隙,是重叠的,电子受激可以从满带进入重叠着的空带或者导带,引起导电。如金属镁,它的最高能量的满带是3s能带,最低能量的空带是3p能带,它们是重叠的,没有间隔,3s能带(满带)的电子受激,可以进入3p能带(空带),向正极方向移动,同时满带因失去电子形成带正电的空穴,向负极方向移动,引起导电。又如,铜、银、金的导电性特别强,是由于它们的充满电子的(n-1)d能带(满带)与半充满的ns能带(导带)是重叠的,其间没有间隙,(n-1)d满带的电子受激可以进入ns导带而导电。
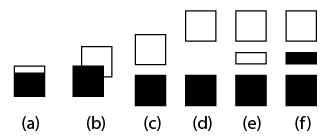
(图中涂黑的部分充满电子)
(a)、(b)导体,(c)本征半导体,(d)绝缘体,(e)、(f)掺杂半导体
图3-13能带的带隙示意图
(5)能带理论是一种既能解释导体(常为金属与合金),又能解释半导体(常为半金属及其互化物)和绝缘体(大多数典型非金属单质和典型化合物)性质的理论,还可定量地计算引入杂质引起的固体能带结构的变化而导致固体性质的变化。简单地说,按照能带理论,绝缘体满带与空带之间有很大带隙,电子不可逾越,因而不能导电;典型的半导体(本征半导体)的满带与空带之间的带隙较小,受激电子可以跃过,当电子跃过满带与空带之间的带隙进入空带后,空带的电子向正极移动,同时,满带因失去电子形成带正电的空穴向负极移动,引起导电。有的半导体需要添加杂质才会导电。杂质的添入,本质上是在禁带之间形成了一个杂质能带(满带或空带),使电子能够以杂质能带为桥梁逾越原先的禁带而导电,参见图3-13。
(6)由此可见,按照能带理论,带隙的大小对固体物质的性质至关重要。
能带理论还可以解释固体的许多物理性质和化学性质。例如,金刚石的满带与空带之间的带隙宽度为5.4 eV,很宽,可见光的能量大大低于5.4 eV,不能使满带的电子激发到空带上去,因而当一束可见光透过金刚石时不发生任何吸收,纯净的金刚石呈无色透明;等等。
(资料3、5摘编自北京师范大学等编《无机化学(上册·第四版)》,高等教育出版社,2002年版)

- 全部评论(0)
