勒沙特列原理运用中的“特例”分析
时间:2016-05-12 10:40 来源:未知 作者:邵磊 点击:次 所属专题: 勒沙特列原理盲区
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
勒沙特列原理(即化学平衡移动原理)是化学学 习过程中极为重要的原理,两次诺贝尔奖得主鲍林曾告诫学生说:你可以忘记化学中的很多东西,但不要忘记勒沙特列原理。这足以说明勒沙特列原理的重要性。然而同学们在使用勒沙特列原理的时候,不能真正理解该定律为经验规律,使用过程有一定的局限性和条件性,若使用不当,可能会走入一些误区。
1 、“恒温、恒压”与“恒温、恒容”的不同
勒沙特列原理指出,若增大反应物的浓度,平衡将向正反应方向移动。需要注意的是勒沙特列原理属于经验定律,主要适用于恒温、恒容条件,而恒温、恒压条件下,增大一种反应物的浓度,另外一种反应物的浓度可能会减少,勒沙特列原理可能会失去其意 义,此时,若借助化学平衡常数与浓度商的关系推断, 则更容易得出正确答案.
例1:在装有可移动活塞的容器中进行如下反应:
(1)N2(g)+3H2(g) NH3(g),反应达到平衡 后,测得NH3的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中又通入少量的H2,再次 达到平衡后,测得NH3的物质的量为bmol,请比较 a、b的大小,并说明理由。
NH3(g),反应达到平衡 后,测得NH3的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中又通入少量的H2,再次 达到平衡后,测得NH3的物质的量为bmol,请比较 a、b的大小,并说明理由。
(2) 上题中若向平衡体系中通入的是少量N2,请通过分析,讨论a、b的大小 .
分析:如果不仔细审题,未分清恒温、恒压还是恒温、恒容条件,就会简单地认为只要增加反应物的浓度,反应就会向正反应方向移动,生成物的物质的量一定增加.其实针对可逆反应的化学平衡体系,分 析问题时要关注恒温、恒压还是恒温、恒容条件,借助 化学平衡常数,定量推算,可顺利得解.
(1) 为说明问题方便,设原浓度皆为1 mol/L, 加入H2时,H2的浓度增大,设为原浓度的x倍(x> 1),N2、NH3的浓度均减小相同倍数,设为原来浓度的y倍(y<1),则Q(浓度商) =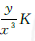 (K为平衡常数),所以Q〈K,平衡向正反应方向移动,故a<b.
(K为平衡常数),所以Q〈K,平衡向正反应方向移动,故a<b.
(2) 设原浓度皆为1 mol/L,加入N2时,N2的浓度增大,设为原浓度的x倍(x>1),H2、NH3的浓度均减小相同倍数,设为原来浓度的y倍(y〈1),则Q(浓度商)=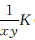 (K为平衡常数),xy可以等于、大 于或小于1,所以Q、K大小无法比较,我们可以讨论分析如下:
(K为平衡常数),xy可以等于、大 于或小于1,所以Q、K大小无法比较,我们可以讨论分析如下:
若xy = 1,则a = b ;若xy >1,则a <b ;若xy <1,则 a >b.
2、固体或纯液体对平衡体系不发生影响
勒沙特列原理研究的是可逆反应的体系,其中气体及溶液一般可以借助浓度的变化情况分析其移动 的方向,而在可逆反应体系中,若有固体物质存在,固体物质浓度一般设定为1,在化学平衡常数表达式中 一般不书写出来,故使用勒沙特列原理分析其可能反 应时,要特别关注固体或纯液体物质的存在情况.
例2:某恒温密闭容器中,可逆反应X(s) Y + Z(g) ΔH>0达到平衡.缩小容器体积,重新达到平 衡时,Z(g)的浓度与缩小体积前的平衡浓度相等.以 下分析正确的是( ).
Y + Z(g) ΔH>0达到平衡.缩小容器体积,重新达到平 衡时,Z(g)的浓度与缩小体积前的平衡浓度相等.以 下分析正确的是( ).
A.产物Y的状态只能为固态或液态;
B.平衡时,单位时间内消耗的n (X):n(Y) = 1: 1;
C.保持体积不变,向平衡体系中加入Y,平衡可 能向逆反应方向移动;
D.若开始时向容器中加入1 mol Y和1 mol Z, 达到平衡时放出热量Q=ΔH
该题若仅仅借助勒沙特列原理分析,会以为改变条件为压缩体积,物质Z的浓度会增大,重新达到新的平衡时,Z的浓度即使减少了,也会 比初始浓度大,而实际情况并非如此,此时要借助化学平衡常数分析才能够顺利得出答案。若Y是气体, 平衡常数K=c(Y)×c(Z),恒温下,K不变,若c(Z) 不变,则c(Y)也不变;若Y是非气体,平衡常数K = c(Z),恒温下,K不变,Z(g)的浓度不变,所以选项A 错误。根据平衡状态的判断方法,知V(正)=V(逆)时, 单位时间内消耗的n(X):n(Z) = 1:1,可知选项B正 确(注意,不是浓度消耗相等).若该反应不属于可逆反 应,则选项D正确,但该反应属于可逆反应,反应不能 进行到底,因此达到平衡时放出热量小于ΔH,选项D 错误。答案为B、C.
3、改变条件时可能引发副反应
勒沙特列原理指出增加反应物的浓度会使化学 平衡向正反应方向移动,但是,针对具体的化学反应 而言,可能会因为增大了反应物的浓度,引发一些副反应,与实际要研究的可逆反应的结果截然不同,所以,改变影响平衡的一些条件时,我们还要特别关注 是否会出现一些副反应的存在情况。
例3:浅绿色Fe(NO3)2溶液中存在如下平衡: Fe2++2H2O Fe(OH)2+2H+,若向该平衡体系中 滴加足量的稀硫酸来增大H+的浓度,则溶液的颜色 变化情况为( ).
Fe(OH)2+2H+,若向该平衡体系中 滴加足量的稀硫酸来增大H+的浓度,则溶液的颜色 变化情况为( ).
A变黄;B变深;C变浅;D无变化
根据题给的可逆反应分析,滴加稀硫酸,溶 液中的H+的浓度增大,若仅仅借助勒沙特列原理,则平衡会向逆反应方向移动,造成Fe2+的浓度增大,此时会容易错误地认为溶液的颜色要变深, 错误选出答案为B。然而要注意滴加硫酸后,NO3-在 大量H+的作用下具有很强的氧化性,可以将Fe2+氧 化为Fe3+,因为Fe3+在溶液中显黄色,所以溶液要变黄。答案为A.
4、反应的特殊性带来的“意料之外”
使用勒沙特列原理分析相关化学平衡移动问题时,一般会错误地认为,增大反应物的浓度平衡向正反应方向移动,若增大生成物的浓度,平衡则会向逆 反应方向移动,故增大反应物的浓度改为增大生成物的浓度,造成的结果应该截然相反,其实不然,分析相关问题时,要学会根据具体的反应特点分析,其结果 可能会出乎我们的意料之外。
例4: 恒温时,在一个固定容器内发生反应 2NO2(g) N2O4 (g) ΔH < 0,达到平衡后, n(NO2)/n(N2O4)=a 在恒温、恒容条件下,甲同学 向反应体系中增加NO2,再次达到平衡时, n(NO2)/n(N2O4) = b,乙同学向反应体系中增加 N2O4,再次达到平衡时,n (NO2 )/n(N2O4 )=c,下列 说法正确的是( ).
N2O4 (g) ΔH < 0,达到平衡后, n(NO2)/n(N2O4)=a 在恒温、恒容条件下,甲同学 向反应体系中增加NO2,再次达到平衡时, n(NO2)/n(N2O4) = b,乙同学向反应体系中增加 N2O4,再次达到平衡时,n (NO2 )/n(N2O4 )=c,下列 说法正确的是( ).
A a >b ; B a>c ; C a <b ; D a <c
该题容易误认为甲、乙二位同学的结论应该相反,若选项A正确,则选项B必然错误.但 若仔细分析该反应特点,反应物和生成物都只有一 种,该反应达到平衡后,再通入NO2后,相当于压强 变大,平衡向右移动,n(NO2)/n(N2 O4)的比值会减 小,若达到平衡后,再通入N2O4,可以借助极端假设 法,相当于增加了NO2,最终造成n(NO2)/n(N2O4) 的比值仍然会减小。答案为A、B .
5、多个条件同时改变时要综合分析
使用勒沙特列原理分析平衡移动的结果时,有时候会片面地认为试题仅仅改变了 一个条件,其实不然,有时候一个条件的改变,会造成多个条件的变化,分析该类问题时,要学会综合分析。
例5: pH均为4的盐酸与醋酸溶液等体积混 合,温度保持不变,下列相关说法正确的是( )
A.醋酸溶液将盐酸稀释,H会变大;
B.盐酸将醋酸溶液稀释,pH会变小;
C.醋酸电离平衡没有发生移动,H不变;
D.混合后 c(Cl-)、c(CH3COO-)及 c(H+ )均减少
醋酸溶液中存在着电离平衡,容易错误地利用勒沙特列原理分析,认为加入盐酸,醋酸浓度减小,由此会促进醋酸的电离平衡,pH会变小,错误地得出答案为B .仔细审阅该试题提供的条件,可以发现,2种酸的初始pH相同,醋酸中存在Ka =c(CH3COO-)× c(H+ ) ÷c(CH3COOH),滴加盐酸,醋酸溶液被稀释,c(CH3COO- )、c(CH3COOH)均会减小,且减小的倍 数相同,而c(H+ )并没有变化,浓度商与常数Ka仍然相同,该醋酸的电离并没有发生移动.答案为C.
例6:在一个不导热的密闭反应器中,只发生2 个反应:A(g)+B(g) 2C(g) ΔH1<0; X(g) +3Y(g)
2C(g) ΔH1<0; X(g) +3Y(g) 2Z(g) ΔH2>0。
2Z(g) ΔH2>0。
进行相关操作且达到平衡后(忽略体积改变所做 的功),下列叙述错误的是( ).
A.等压时,通入惰性气体,C 的物质的量不变;
B.等压时,通入Z气体,反应器中温度升高;
C.等容时,通入惰性气体,各反应速率不变;
D.等容时,通入Z气体,Y的物质的量浓度增大
分析该试题时,易错误认为,等压时,通入惰 性气体,对可逆反应“A(g)+B(g) 2C(g)” 的平衡没有影响,所以物质C的物质的量不变,选项 A应该是正确的。该错误分析的根源就在于片面认为试题中仅仅改变了 一个条件,其实该试题告诉我们, 一个条件改变后,会有多个条件随之改变。等压时,通 入惰性气体,该反应容器的体积必然增大,由此就会 引起反应“X(g) +3Y(g)
2C(g)” 的平衡没有影响,所以物质C的物质的量不变,选项 A应该是正确的。该错误分析的根源就在于片面认为试题中仅仅改变了 一个条件,其实该试题告诉我们, 一个条件改变后,会有多个条件随之改变。等压时,通 入惰性气体,该反应容器的体积必然增大,由此就会 引起反应“X(g) +3Y(g) 2Z(g) ΔH2>0”发生移 动,又因是不导热的密闭反应器,必然又会引起温度 的改变,温度的改变又会引起“A(g)+B(g)
2Z(g) ΔH2>0”发生移 动,又因是不导热的密闭反应器,必然又会引起温度 的改变,温度的改变又会引起“A(g)+B(g) 2C(g) ΔH1<0”的移动,所以物质C的量一定会发生改变, 选项A错误。答案为A。
2C(g) ΔH1<0”的移动,所以物质C的量一定会发生改变, 选项A错误。答案为A。
综上所述,在具体解答相关化学平衡问题时,常 常会使用到勒沙特列原理,但使用勒沙特列原理解决有关的问题时,不能凭经验简单处置,要深刻理解勒沙特列原理的本质,多角度地考虑问题,只有这样才能避免发生经验主义的错误,才能避开试题设置的陷阱。

- 全部评论(0)
