工艺流程题之分离提纯类的考向与复习
时间:2021-03-21 10:27 来源:未知 作者:化学自习室 点击:次 所属专题: 物质分离提纯
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
知识归纳(考向答题模板)
1.物质分离提纯的原则
(1)不增:不引入新的杂质。
(2)不减:不减少被提纯的物质。
(3)易分离:被提纯物与杂质易于分离。
(4)易复原:被提纯的物质易恢复原来的组成、状态。
2.常用的提纯方法
水溶法 | 除去可溶性杂质 |
酸溶法 | 除去碱性杂质 |
碱溶法 | 除去酸性杂质 |
氧化剂或还原剂法 | 除去还原性或氧化性杂质 |
加热灼烧法 | 除去受热易分解或易挥发的杂质 |
调节溶液的pH法 | 如除去酸性Cu2+溶液中的Fe3+等 |
3.常用的分离方法
过滤 | 分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法 |
萃取和分液 | 利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴 |
蒸发结晶 | 提取溶解度随温度变化不大的溶质,如NaCl |
冷却结晶 | 提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等 |
蒸馏或分馏 | 分离沸点不同且互溶的液体混合物,如分离乙醇和甘油 |
冷却法 | 利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气 |
复习补短板
1.增大原料浸出率(离子在溶液中被浸出的百分率)的措施:搅拌、升高温度、延长浸出时间、增大气体的流速(浓度、压强)、增大气液或固液接触面积。根据物质的具体性质,原料浸泡可分为水浸、酸浸、碱浸、醇浸等。
2.过滤问题
(1)3个基本操作
①检验溶液中离子是否沉淀完全的方法:将溶液静置一段时间后,用胶头滴管取上层清液少许放入小试管中,向其中滴入沉淀剂,若无沉淀生成,则说明离子沉淀完全。
②洗涤沉淀:沿玻璃棒往漏斗中加蒸馏水至液面浸没沉淀,待水自然流下后,重复操作2~3次。
③检验沉淀是否洗涤干净的方法:取少量最后一次的洗涤液于试管中,向其中滴入某试剂,若没有特征现象出现,则证明沉淀已洗涤干净。
(2)特定洗涤目的
①冰水洗涤的目的:洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗。
②乙醇洗涤的目的:降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物。
3.结晶方式
(1)蒸发浓缩、冷却结晶:适用于杂质的溶解度随温度变化不大的物质分离提纯,如除去KNO3中的少量NaCl或受热易分解的物质,如晶体水合物、铵盐等。
(2)蒸发结晶、趁热过滤:适用于杂质的溶解度随温度变化较大物质的分离提纯,可减少杂质晶体的析出,如除去NaCl中的少量KNO3。趁热过滤的方法:漏斗预热,用少量热蒸馏水通过过滤器,带加热装置的漏斗、抽滤。
提醒:晶体的干燥:要得到干燥的晶体,常见的干燥方法有自然晾干、滤纸吸干、在干燥器中干燥、烘干(适用于热稳定性较好的物质)。
4.调节溶液pH分离提纯
(1)控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。例如:已知下列物质开始沉淀和沉淀完全时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 1.5 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
若要除去Mn2+溶液中含有的Fe2+,可先用氧化剂把Fe2+氧化为Fe3+,再调节溶液的pH在3.7≤pH<8.3。
(2)调节pH所需的物质应满足两点:能与H+反应,使溶液pH增大;不引入新杂质。例如:要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等物质来调节溶液的pH。
高考题重现
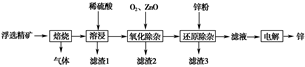
1.(2018·全国卷Ⅱ,T26)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为____________________________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是________,若不通入氧气,其后果是________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为__________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为_______________________________;
沉积锌后的电解液可返回________工序继续使用。
[三步审读]
[解析]
(1)在焙烧过程中ZnS和O2反应生成ZnO和SO2。
(2)溶液中的Pb2+与SO42-不能共存,生成PbSO4沉淀,SiO2不溶于H2SO4,即滤渣1中含SiO2和PbSO4。氧化除杂过程中O2能将溶液中Fe2+氧化生成Fe3+,加入ZnO能调节溶液的pH,促进Fe3+完全水解。由题表知Fe2+、Zn2+开始沉淀和沉淀完全时的pH非常接近,若不通入O2使Fe2+氧化为Fe3+,加入ZnO后无法除去Fe2+,会影响Zn的纯度。
(3)根据题中信息可知还原除杂工序中涉及的离子反应式为Cd2++Zn=Cd+Zn2+。
(4)结合图示可知电解ZnSO4溶液时生成Zn,即电解时Zn2+在阴极被还原,电极反应式为Zn2++2e-=Zn。沉积Zn后的电解液中主要含有H2SO4,可返回溶浸工序中继续使用。
[答案](1)2ZnS+3O2=2ZnO+2SO2
(2)PbSO4 调节溶液的pH 无法除去杂质Fe2+
(3)Cd2++Zn=Cd+Zn2+
(4)Zn2++2e-=Zn 溶浸
母题变式练
(1)“氧化除杂”过程除了加ZnO外还可以加______________,O2的作用是_______________。
(2)滤渣洗涤的操作为_________________。
(3)“电解”制备Zn的阳极反应为_______________________________。
[答案](1)Zn(OH)2或ZnCO3 把Fe2+氧化为Fe3+
(2)沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待蒸馏水自然流尽后,再重复操作2~3次
(3)4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑
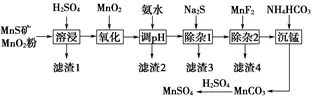
2.(2019·全国卷Ⅲ)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉 淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完 全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和______________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式__________________________________。
(2)“氧化”中添加适量的MnO2的作用是________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是________________。
(6)写出“沉锰”的离子方程式_____________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=1/3时,z=________。
[解析]
(1)硫化锰矿及二氧化锰粉末中加入硫酸后,发生氧化还原反应:MnO2+MnS+2H2SO4=2MnsO4+S+2H2O,故滤渣1的主要成分为S和SiO2(不溶性硅酸盐)。
(2)Fe2+沉淀完全时,Mn2+已经开始沉淀,故加入MnO2是为了将溶液中的Fe2+氧化为Fe3+,便于除去。
(3)除去Fe3+及Al3+,应使二者沉淀完全,故pH应大于4.7。
(4)锌和镍的硫化物都难溶于水,故“滤渣3”的主要成分为ZnS、NiS。
(5)“除杂1”步骤结束后,杂质金属阳离子只有Mg2+,加入MnF2形成MgF2沉淀而除去Mg2+,若溶液酸度过高,H+浓度偏大,则F-与H+结合形成HF,使MgF2沉淀溶解平衡正向移动而重新溶解。
(6)“沉锰”时加入NH4HCO3发生反应:Mn2++2HCO=MnCO3↓+CO2↑+H2O。
(7)根据化合物中各元素化合价代数和为0的原则,求得z=1/3。
[答案](1)SiO2(不溶性硅酸盐)MnO2+MnS+2H2SO4=2MnSO4+S+2H2O
(2)将Fe2+氧化为Fe3+
(3)4·7
(4)NiS和ZnS
(5)F-与H+结合形成弱电解质HF,MgF2⇌Mg2++2F-平衡向右移动
(6)Mn2++2HCO=MnCO3↓+CO2↑+H2O
(7)1/3

- 全部评论(0)
