第六讲:学会物质的分离与提纯
时间:2021-04-21 15:01 来源:高中化学教学研究 作者:张德金 点击:次 所属专题: 物质分离提纯
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对自然界中得到的物质进行分离和提纯(又叫除杂),是分析物质的性质和应用物质解决问题的前提。
在学习分离和提纯的方法之前,需要提醒学生的是,应该先对常见物质的物理性质中的状态、水溶性、密度和化学性质(包括毒性)比较熟练。
1、常见的分离提纯的物理方法
| 方法 | 物质状态 | 示例 |
洗气 | 混合气体 | 除去Cl2中少量的HCl |
吸附 | 混合气体或液体 | 用固体CaCl2干燥Cl2 |
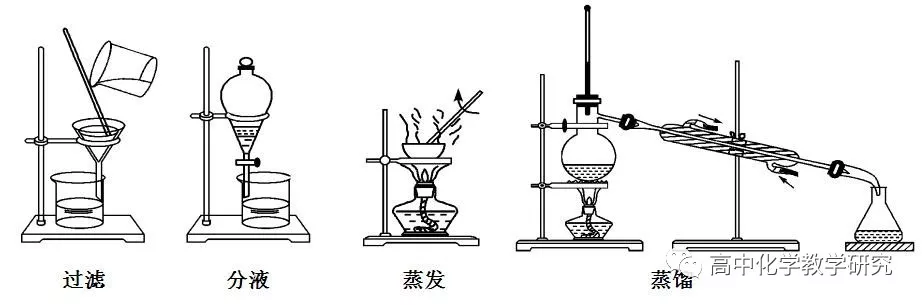
过滤 | 液体与难溶固体 | 除去NaCl溶液中的沙子 |
蒸发 | 溶液(取固体) | 用NaCl溶液得到NaCl固体 |
分液 | 互不相溶液体 | 苯与水分离 |
蒸馏 | 溶液(取液体) | 酒精与水分离 |
升华 | 混合固体 | 固体NaCl与I2 |
液化 | 混合气体 | 分离空气中的N2与O2 |
渗析 | 胶体 | NaCl与蛋白质溶液 |
盐析 | 胶体 | 水与蛋白质溶液 |
层析 | 多种溶质溶液 | 分离溶液中的FeCl3与CuCl2 |
浮选 | 混合固体 | 沙中淘金 |
扩散 | 混合气体 | 235UF6和238U F6的分离 |
电泳 | 有些胶体 | 从Fe(OH)3胶体分离Fe(OH)3 |
空气 吹出 | 多种可能 | 稻米与米糠的分离 溴水中分离Br2 |
2、在物理方法分离中注意的一些问题。
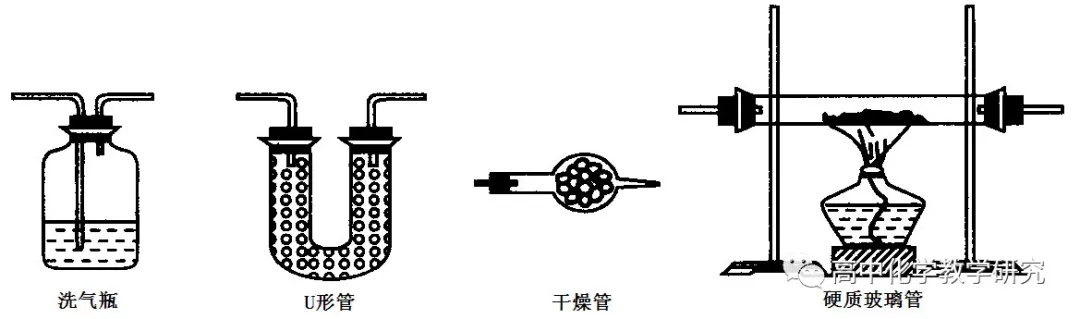
(1)洗气:
①若保留的气体在洗液中存在少量溶解,可以加入抑制剂降低溶解度。
如除去Cl2中少量的HCl,用饱和食盐水。
②若被洗掉的气体极易溶于水,且在混合气体中占的比例较高,可能会有倒吸的危险,也需要在水溶液中加入抑制溶解的溶质。
除去Cl2中少量的HCl,饱和食盐水还有减慢HCl溶解的功能。
除掉H2中较多的NH3时,用通过有饱和(NH4)2SO4的水或稀硫酸洗气。
(2)吸附:用U形管、干燥管吸附时,加入的固体试剂应该呈蓬松状,或用玻璃丝团并将粉状试剂洒在上面。
(3)过滤:若得到溶于水的固体,则需要滤液再进行结晶。如除去KCl固体中的沙子。若想得到难溶于水的固体,则需要固体洗涤,干燥。如除去CuO固体中少量的NaCl。
(4)分液:若有萃取,分液后的溶液,要想得到溶质,还需要对溶液进行蒸馏。如从碘水中得到碘单质。
(5)扩散法:针对的是性质几乎完全相同的混合气体,像同种元素的不同核素的气体单质或化合物之间的分离,用这种方法。
(6)还有一些其它的物质的状态组合,需要别的处理方法。
①气体溶于液体的混合:采用加热、减压的方法来分离。
如除掉水中溶解O2,采用将水煮沸一段时间的方法。
去掉汽水中的CO2,采用减压和摇晃的方式。
②气体吸附于固体的混合:采用加热或减压的方法来分离。
分离贮氢材料中的H2,对贮氢材料加热,并收集气体。
③若提取难溶性固体中的少量液体,用萃取蒸馏或萃取蒸发法。
用超临界CO2(液体)从茉莉花瓣中提取茉莉花香精:先用超临界CO2(液体)浸泡茉莉花瓣,再过滤得到溶液,然后改变压强温度让CO2自然蒸发,得到茉莉花香精。
④铁粉与铜粉的混合,用磁铁吸引。(铁铜合金无法用磁铁吸引)
⑤若两种固体都溶于水:还可以采用饱和溶液浸泡法。
除去NaCl固体中少量的KCl,将固体放于一定量的饱和NaCl溶液中,放置一段时间,过滤,即可得到纯净的NaCl固体(如果想加快速度可以加热和搅拌)。
3、若需要利用化学反应提纯时,选择试剂的思路。
化学分离要用物质的化学性质,而化学性质主要借助于复分解反应,氧化还原反应,分解反应。
在利用化学方法进行提纯时,如果用到试剂,则试剂一般要过量,注意过量试剂是否带来影响。
(1)选择试剂与方法的思路
采用对比法,找到两种物质之间化学性质的不同,利用杂质的独有的化学反应选择除杂试剂,再选用适当的分离方法即可。
如CO与CO2的混合气体,对比两者的化学性质,得到CO具有还原性,CO2能和碱发生类似中和反应。
若除掉CO2,可选用NaOH溶液和洗气的除杂方法。
若除掉CO,可选用CuO和硬质玻璃管加热方法。
(2)常见的化学处理方法
有酸碱处理法、沉淀法、离子交换法、氧化还原法、电解法、热分解法等。
①酸碱处理法(包括用盐、氧化物处理)
除去Fe2(SO4)2固体中的少量Fe(OH)3:溶于水后加稍过量的稀H2SO4,然后蒸发结晶,加热分解。
除去CO2中少量的HCl:通过饱和NaHCO3溶液后干燥。
②沉淀法
除去NaCl固体中的少量MgCl2:溶于水后加稍过量的NaOH,过滤后,再加适量的盐酸,然后蒸发结晶。
除去CaCO3中少量的CaSO4,加入水中,再加入过量的Na2CO3,充分反应后,过滤,洗涤,干燥。(CaSO4微溶于水)
③离子交换法
除去硬水中的各种电解质,用阳离子交换柱和阴离子交换柱进行离子交换。
④氧化还原法
除去FeCl2溶液中的少量FeCl3,加稍过量的Fe充分反应后过滤。
除去FeCl3溶液中的少量FeCl2,加稍过量的Cl2充分反应。
⑤电解法
除去粗铜中的杂质,采用电解法。(在选修四第四章第三节的电解精炼铜部分)
⑥热分解法
除去Na2CO3中少量的NaHCO3,用大试管进行热分解。
(3)需要解决除杂质时除杂试剂的过量问题。
①除去FeCl2溶液中的少量FeCl3时,稍过量的Fe处于固体状态,直接过滤即可。
②除去FeCl3溶液中的少量FeCl2,稍过量的Cl2由于溶解度不大,且易挥发,不会对FeCl3溶液的纯净程度产生多少影响,一般默认为不处理。
③除去NaCl中少量的Na2SO4时,稍过量的BaCl2必须除掉,所以加稍过量的Na2CO3,过滤后,在滤液中,再加稍过量的盐酸,蒸发结晶。
4、分离与提纯的区别
提纯是将混合物中少量的杂质除掉。分离是将混合物中物质分开。
例如,要除掉Mg(OH)2中少量的Al(OH)3,只需要用稍过量的NaOH充分溶解,过滤,洗涤,晾干固体即可。
若是分离Mg(OH)2和Al(OH)3的混合物,需要用稍过量的NaOH充分溶解,过滤,洗涤,将得到的固体晾干得到Mg(OH)2。还要将得到的滤液通入足量的CO2,然后再对滤液进行过滤,洗涤,将得到的固体晾干得到Al(OH)3。
又例如,KNO3与NaCl的混合物,要提纯得到纯净的KNO3,是能做到的。要分离KNO3和NaCl,在高中阶段几乎是不可能的。
5、分离提纯时注意的一些细节问题
(1)蒸发结晶,降温结晶,重结晶的区别
①蒸发结晶的对象是,只有一种可溶性溶质的溶液,并且溶质具有热稳定性。
如从NaCl溶液中得到NaCl固体。
②降温结晶的对象是,只有一种可溶性溶质的溶液,并且固体溶质受热不稳定。如带结晶水的盐、酸式盐、弱碱、铵盐、硝酸盐等。
如从CuSO4水溶液中得到CuSO4·5H2O,采用降温结晶。
降温结晶的操作步骤为蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
③重结晶是指将降温结晶得到的固体,再次溶解,蒸发,降温结晶,循环多次。
如除去KNO3中少量的NaCl,采用重结晶。
重结晶的目的是采用多次降温结晶的方式,降低杂质在混合物中的比例,直至杂质消失为止。
(2)不同分离方法的分离效果问题。
①洗气:如果是只利用溶解性,洗气后的气体中一般都会有少量的杂质残留,所以利用化学试剂洗气的效果能更好一些。但化学试剂如果不浓,气体通入速度又快,处理效果也会不好。利用多孔球等是更好的选择。
如用酸性KMnO4溶液除去SO2时,要用大量的浓溶液,保证溶液不褪色。而用酸性KMnO4溶液检测SO2时,要用稀溶液,让溶液很快褪色。
②吸附:用硬质玻璃管、U形管等处理混合气体时,若管不够长,试剂分布不松散,通入速度快,处理效果也不好。
③分液:分液后得到的两种液体,一般都溶解着微量的另一种液体。
④蒸馏:若是难挥发的固体溶解于液体的混合,蒸馏得到的液体会是纯净的。
若是两种液体混合,得到的馏出液和剩余液中都会有对方的残留。
⑤电解法:除去粗铜中的杂质,采用电解法时,若通电的电流过大,也会导致分离结果不纯。
(3)提纯方法的成本、分离效果(或分离标准)、操作手段的复杂性,对分离试剂、分离方法的选择有影响。
①降低酸性工业废水中酸性一些金属离子,用CaO或Ca(OH)2不用NaOH,考虑的是成本。
除去工业废水中的重金属离子,用Na2S,不用CaO或Ca(OH)2,是因为达不到处理标准。
除去CO2中少量的CO,用O2和持续点燃的方法,存在分离O2的量无法控制、装置的设计非常复杂等。
除去N2和H2中的NH3,在实验室用洗气法操作起来很容易,在工业上用液化法更节省成本。
②分离提纯方法的选择,尽量选容易操作的。
洗气、分液比过滤操作要简单,过滤又比蒸发、灼烧、蒸馏要容易一些。而过滤的缺点是,有的时间会很长。
如果萃取分液后,还要蒸馏,那就要复杂更多。
③利用化学反应,可以让复杂的操作变的简单或分离结果变得更纯净。
除掉苯(沸点80℃)中少量的甲苯(沸点110.8℃),可以直接蒸馏。也可以利用高锰酸钾溶液和NaOH溶液,将分离方法由蒸馏变为分液,提纯结果会更纯净。但缺点是要使用两种化学药品。
④如果选用化学反应,尽量选不需要反应条件的,药品尽量选常见的,便宜的,产物污染小的。如NaOH、稀H2SO4、NaCl、Na2CO3等。
(4)分离或提纯是一个过程,要选择仪器,选择方法,设计步骤,注意思考这个过程的每一个环节,而不只是掌握一个动词。
每种混合物的分离方法不一定只有一种,要进行灵活的选择,不要只是机械套用。
另外,分离与提纯不仅是化学中的知识问题、实验问题,里面隐含着对操作行为、步骤逻辑的思考和理解,这些属于实践、活动、劳动,所以实践、活动、劳动的经验对于弄明白分离提纯方法是很重要的,对无需大量记忆就能很快学会也是很重要的。
【练习】
1、写出下列混合物的分离试剂和分离方法(答案不唯一,合理即可,若不需要试剂,可以不填)
(1)除去O2中少量的Cl2,试剂: 分离方法: 。
(2)除去CO2中少量的SO2,试剂: 分离方法: 。
(3)将CCl4与水的混合溶液分离,试剂: 分离方法: 。
(4)从碘水中得到固体碘,试剂: 分离方法: 。
(5)将混合固体NaCl与BaSO4分离,试剂: 分离方法: 。
(6)除去Fe2O3中少量的Fe(OH)3,试剂: 分离方法: 。
(7)除去水中少量的NaCl,试剂: 分离方法: 。
(8)分离出水溶液的溶解的蛋白质,试剂: 分离方法: 。
(9)除去淀粉溶液中的NaCl,试剂: 分离方法: 。
2、写出试剂、分离方法、仪器和大致的操作步骤,注意语言的严谨性。
(1)除去苯中少量的溴单质: 。
(2)将Na2SO4和Cu2SO4的混合固体分离开: 。
(3)较大量的稀碘水中得到固体碘: 。
3、乙酸、乙醇、乙酸乙酯常温下均为液体,相互溶解。乙酸乙酯微量溶于水,难溶于饱和Na2CO3溶液,乙酸、乙醇均易溶于水。乙醇的沸点为78℃,乙酸的沸点为117.9℃,硫酸的沸点为337℃。
将乙酸、乙醇、乙酸乙酯三者的混合液一一分离,描述所用的试剂、分离方法、仪器和操作过程。
【练习答案】
1、(1)NaOH溶液、洗气。
(2)酸性KMnO4溶液、洗气。
(3)无,分液。
(4)苯或CCl4、萃取分液和蒸馏。
(5)水、过滤和蒸发。
(6)无、热分解。
(7)无、离子交换或蒸馏。
(8)NaCl、盐析和过滤。
(9)无、渗析。
2、(1)在苯中放入过量的NaOH溶液,将混合液倒入分液漏斗中,充分萃取,静置,将下层液体从分液漏斗下口放出后,将上层液体从上口倒入烧坏中,得到苯。
(2)将混合固体用水溶解,加入稍过量的NaOH溶液后,过滤,洗涤。将滤液蒸发得到的固体用大试管加热,得到Na2SO4(结晶得到的Na2SO4会带结晶水)。将过滤得到的固体用适量的稀硫酸溶解,蒸发溶液得到固体后用大试管加热,得到CuSO4(结晶得到的CuSO4带结晶水)。
(3)在碘水中加入少量CCl4,将混合液倒入分液漏斗中,充分萃取,静置,将下层液体从分液漏斗下口放出后,将其放入蒸馏装置中蒸馏回收CCl4,得到碘。
3、将混合液加入到过量饱和Na2CO3溶液中,用将混合液倒入分液漏斗,充分萃取和反应,静置,将下层液体从分液漏斗下口放出后,将上层液体从上口放出,得到乙酸乙酯。将下层液体用蒸馏装置蒸馏,得到乙醇。将蒸馏后的剩余液体中加入稍过量的稀硫酸,控制温度进行分馏,得到乙酸。

- 全部评论(0)
