细说氢氧化铜与新制氢氧化铜
时间:2021-04-23 09:44 来源:未知 作者:段昌平 点击:次 所属专题: 新制氢氧化铜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高中教材中的新制Cu(OH)2是一个特定试剂名称, 认为新制Cu(OH)2就 是Cu(OH)2 的悬浊液。但事实上新制 Cu(OH)2又不同于Cu(OH)2 , 学生在观察演示实验和做实验时已经注意到这一点。为了区别Cu (OH)2 与新制Cu(OH)2, 以及实验时为什么要制取新制Cu(OH)2, 谈谈个人的看法。
1、Cu(OH)2 与 新制 Cu(OH)2 制取方法及化学成分不同
Cu(OH)2 制取方法:取 2% 的 CuSO4 溶液少许于试管中, 然后滴加NaOH 溶液至 Cu2+沉淀完 全。
现象: 产生蓝色 Cu(OH)2 沉淀 ( 比溶液蓝色 更深) 。
化学反应: Cu2++ 2OH- ==Cu(OH)2 ↓( I)
分散系 (浊液) 中的分散质: Cu( OH)2 、 Na2SO4。
新制 Cu(OH)2制取方法: 取 10% 的NaOH 溶液 2 mL 于试管中, 滴加 4~ 6 滴 2% 的 CuSO4 溶液, 振荡 ( NaOH 远远过量) 。
现象:CuSO4 溶液滴入 NaOH 溶液中产生蓝 色沉淀, 振荡时蓝色沉淀溶解, 得到深蓝色溶液 ( 静置时无沉淀析出) 。
滴加 CuSO4 溶液时: Cu2++ 2OH- ==Cu(OH)2↓
振荡时: Cu(OH)2+2OH-== [ Cu(OH)4]2- (Ⅱ)
分散系 ( 溶液) 中的分散质: Na2[Cu(OH)4] 、 Na2SO4、NaOH。
2、Cu(OH)2 与 新制 Cu(OH)2对热的稳定性不同
加热制取 Cu(OH)2 的试管, 其内蓝色沉淀物 很快变黑。加热新制 Cu(OH)2的试管, 直至 溶液沸腾时仍未见有任何沉淀物产生, 溶液仍为深蓝色。由此说明: 悬浊在水中的 Cu(OH )2 受热时可迅速分解: Cu(OH)2  CuO+ H2O。 /新制Cu(OH)2 对热则很稳定, 即使溶液沸腾 时, Na2[Cu(OH)4] 也不会分解生成 CuO。
CuO+ H2O。 /新制Cu(OH)2 对热则很稳定, 即使溶液沸腾 时, Na2[Cu(OH)4] 也不会分解生成 CuO。
3 、Cu(OH)2 与新制 Cu(OH)2与酸的反应现象不同
向盛有 Cu(OH)2 的试管中滴加硫酸, 随着酸的滴加, 蓝色沉淀逐渐溶解, 最后变为浅蓝色溶 液。反应的离子方程式为: Cu(OH)2 + 2H+== Cu2++ 2H2O
向盛有 新制 Cu(OH)2 的试管中滴加硫酸, 随着酸的滴入, 开始无明显现象, 后来产生粉蓝色 沉淀, 继而产生的沉淀又逐渐溶解, 得到很淡的浅蓝色溶液 ( Cu2+浓度很小) , 反应的离子方程式有 ( 按反应由先至后) :
H+ + OH-== H2O
2 [Cu(OH)4]2- + SO42-+ 6H+== Cu2(OH)2SO4 ( 碱式硫酸铜, 粉蓝色) + 6H2O
Cu2(OH)2SO4 + 2H+== 2Cu2++ SO42- + 2H2O
正因如此, 做检验淀粉水解最终产物葡萄糖 ( 或蔗糖水解产物) 的实验时, 必须将水解之后的溶液进行碱化 ( 用 NaOH 溶液中和作催化剂的硫酸至溶液呈碱性) , 否则硫酸会破 坏新制 Cu(OH)2 试剂。
新制 Cu(OH)2 试剂被硫酸破坏时可能出现 3 种情况:
一是硫酸的量很多, 使新制 Cu(OH)2 按上述反应最后转化为 CuSO4 , 甚至还有大量硫酸存在, 此时葡萄糖与 CuSO4 溶液共热无任何明显现象产生, 即 Cu2+不能氧化葡萄糖分子中的醛基。
二是硫酸的量较少, 只使 新 制 Cu(OH)2试剂中的 NaOH 中和为 Na2SO4 , [ Cu(OH)4]2- 全部转化为 Cu2(OH)2SO4 , 形成粉蓝色浊液, 此时加热混合物至沸腾, 既不会产生红色沉淀, 也不会产生黑色沉淀 (Cu2(OH)2SO4 在 溶液中受热不会分解, 葡萄糖也不会被氧化。
三 是溶液中硫 酸 的量很少, 只中和了新制Cu(OH)2中过量NaOH的一部分, 所得混合溶液仍呈碱性, 在此种情况下加热时可产生红色沉淀, 即葡萄糖可被氧化, 新制 Cu(OH)2被还原为 Cu2O。但后者这种巧合的概率很小, 平时我们做演示对比实验 ( 包括学生不按操作要求做学生实验) 时, 淀粉水解液未经碱化其实验均是失败的。
4、Cu(OH)2 与 新制 Cu(OH)2和葡萄糖反应的现象相同
有趣的是: 向盛有蓝色 Cu(OH)2 沉淀的试管 中加入足量的葡萄糖溶液 ( 或葡萄糖晶体) , 振荡, Cu(OH)2 溶解, 得到绛蓝色溶液( 比新制 Cu(OH)2溶液蓝色更深一些) 。加热该溶液, 产 生砖红色沉淀。其有关反应的化学方程式为:


将上述反应 (Ⅲ)和反应 (Ⅳ)加和起来即得高中教材中的反应: CH2OH( COOH)4CHO+ 2Cu(OH)2 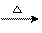 CH2OH(COOH)4COOH + Cu2O↓+ 2H2O 向盛有新制 Cu(OH)2的试管中加入葡萄糖溶液 ( 或固体粉末) , 振荡, 溶液颜色加深, 变为绛蓝色, 由此说明新制 Cu(OH)2试剂与葡萄糖溶液也发生了化学反应:
CH2OH(COOH)4COOH + Cu2O↓+ 2H2O 向盛有新制 Cu(OH)2的试管中加入葡萄糖溶液 ( 或固体粉末) , 振荡, 溶液颜色加深, 变为绛蓝色, 由此说明新制 Cu(OH)2试剂与葡萄糖溶液也发生了化学反应:

再给该混合溶液加热, 迅速产生红色沉淀 ( 若所处环境气温较高时, 不加热也会慢慢反应, 产生红色沉淀) 。其反应方程式为:

将上述反应(Ⅱ)×2和反应(Ⅴ)加和起来也能得到 高中教材中的反应。
5、做醛基氧化反应实验时为何要将 Cu(OH)2 转变 为新制 Cu(OH)2
既然向Cu(OH)2悬浊液中加人葡萄糖可使沉 淀溶解,然后加热所得溶液可产生红色沉淀 (Cu2O),实现了醛基的氧化反应,且现象明显, 为何高中教材中做此实验时未采用此方法,而是让NaOH远远过量制取“新制Cu(OH)2”呢?
其原因有二:
(1)醛基在碱性条件下还原性更强,更易被氧化。
事实上Cu2+转化为Cu(OH)2时Cu(Ⅱ) 的氧化性减弱,(Cu2++ e- = Cu+,  = 0.158 V;Cu(OH)2+e-= 1/2Cu2O + OH- + 1/2H2O,
= 0.158 V;Cu(OH)2+e-= 1/2Cu2O + OH- + 1/2H2O,  = -0. 08 V,但因醛在碱性条件下的 还原性比在酸性条件下的还原性强得多(HCHO
= -0. 08 V,但因醛在碱性条件下的 还原性比在酸性条件下的还原性强得多(HCHO HCOOH,
HCOOH,  = 0.01 V,
= 0.01 V, = -1.07V), 葡萄糖的氧化反应在碱性条件下更易进行,即“新制Cu(OH)2”能加快其化学反应速率,使实验迅速进行,现象明显。
= -1.07V), 葡萄糖的氧化反应在碱性条件下更易进行,即“新制Cu(OH)2”能加快其化学反应速率,使实验迅速进行,现象明显。
(2)减少干扰因素,保证实验 顺利进行。
若直接用Cu(OH)2进行实验,实验过 程中哪怕只有极少量Cu(OH)2完全反应而剩余,Cu(OH)2受热时就会分解产生黑色的CuO, 干扰产生砖红色Cu2O沉淀的现象,导致实验现象不明显,无法证明Cu(OH)2将醛基氧化的事实。 而用“新制Cu(OH)2”做此实验,即使加入的葡萄糖量不足,“新制Cu(OH)2”过量,加热时“新制Cu(OH)2”不会分解产生CuO,有效避免了可能出现的干扰,保证实验有效进行,使实验结果具 有说服力。

- 全部评论(0)
