离子浓度变化对电极电势影响
时间:2022-01-02 13:00 来源:未知 作者:化学自习室 点击:次 所属专题: 电极电势
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、标准电极电势φ的应用
1.利用标准电极电势判断氧化剂、还原剂的相对强弱
氧化型+ne-→还原型
φ值越高,氧化型的氧化能力越强(强氧化剂),共轭还原型还原能力越弱;φ值越低,氧化型的氧化能力越弱,共轭还原型还原能力越强(强还原剂)。
2.用标准电极电势判断氧化还原反应进行的方向
强氧化剂1+强还原剂2=弱氧化剂2+弱还原剂1】
Nernst方程
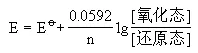
参加电极反应的物质有纯固/液体, 其浓度为“1”。若电极反应中有气体参加,其浓度用“p/p°”表示
二、离子浓度变化对电极电势的影响
在电极反应中,如增加还原态浓度(或减小氧化态浓度),该电对的电极电势数值下降。电极电势数值下降表明此电对的氧化态氧化能力受到削弱,而电对中还原态的还原能力得到加强。当增加Fe3+浓度(或减小还原态浓度),该电对的电极电势数值上升。电极电势数值上升表明此电对的氧化态氧化能力增强,而电对中还原态的还原能力受到削弱。离子浓度变化对电极电势的影响,必然会影响到电池反应的方向。
例:标准状态下,Fe3+与I-不能共存于水溶液中,试计算:当Fe3+为何浓度时(c(Fe2+)=1.0mol/L),才能与I-共存于水溶液中?(己知:φ°(Fe3+/Fe2+)=0.77V,φ°(I2/I-)=0.54V,c(I-)=1.0mol/L)。
【析】标准状态下,φ°(Fe3+/Fe2+)>φ°(I2/I-)=0.54V,所以Fe3+与I-不能共存于水溶液中,对应电极反应为:
(+)Fe3++ e-=Fe2+
(-)I2+2e-=2I-
电池反应:2Fe3++ 2I- -=2Fe2++I2
电动势E°=φ°(Fe3+/Fe2+)-φ°(I2/I-)
若Fe3+与I-能共存于水溶液中,则E<0;即φ(Fe3+/Fe2+)≤φ(I2/I-)。
由于c(I-)=1.0mol/L,则φ(I2/I-)=φ°(I2/I-)=0.54V,
φ(Fe3+/Fe2+)=φ°(Fe3+/Fe2+)+(RT/F)×ln(c(Fe3+)/c(Fe2+))==0.54V,
0.77+(RT/F)×ln(c(Fe3+)/1.0)==0.54V,
c(Fe3+)=1.292×10-4mol
思考:题中条件下,这样的c(Fe3+)浓度,有啥实际意义?
例:结合制取氯气的实验室方法的例子,我们讨论MnO2与盐酸作用制取Cl2的反应。以明确介质对氧化还原反应的影响。
MnO2+4HCl=MnCl2+Cl2+2H2O
有关的两电极反应分别是:
(+)MnO2+4H++2e-=Mn2++2H2O
(-)Cl2+2e-=2Cl-
对于φ°(MnO2/Mn2+)来说,奈斯特方程的表示式可以写成:
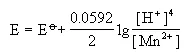
假设[Mn2+]=1mol/L。于是上式就变为:
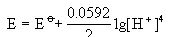
可以看出,[H+]增加(即增加酸度),E值随之增加,也就是说酸度增大,可以提高MnO2的氧化能力。
对于E(Cl2/Cl-)来说,奈斯特方程的表示式可以写成:
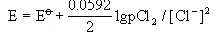
为简化起见,设PCl2为标准状态(pCl2=?),于是上式变成
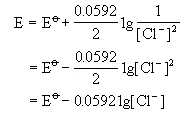
即当[Cl-]浓度增加,E值下降,即此电极电势随Cl-浓度增加而下降。也就是说Cl-增加使Cl-的还原能力增加。

- 全部评论(0)
