电极电势如何测定?
时间:2023-02-13 17:14 来源:未知 作者:化学自习室 点击:次 所属专题: 电极电势
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我们现在还无法测定金属与盐溶液之间电极电势的绝对值,只能选用某种电极作为标准,其他电极与之比较,求得电极电势的相对值。通常采用标准氢电极作为比较的标准。
标准氢电极(如图4-8)是这样构成的:在铂片上镀一层蓬松的铂黑,把它放入c(H+)为1 mol/kg的硫酸中,在25℃时,不断地通入压强为100 KPa的纯净的H2,这时H2被铂黑吸收,而被吸收的H2又力图把自己的离子投入溶液,因此,这个电极像是由H2构成的。被H2饱和的铂片与c(H+)为1 mol/kg的硫酸之间所产生的电势差叫做标准氢电极的电极电势,规定它为零。
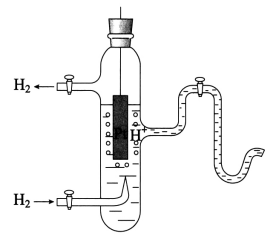
图4-8 标准氢电极示意图
为了测定金属的标准电极电势,可以把某种金属放入它的离子浓度为1 mol/kg的盐溶液中,并跟标准氢电极构成原电池。测定这个原电池的电动势,就可以求得这种金属的标准电极电势,常用φ-表示。几种常见电极的标准电极电势列于表4-1中。
表4-1 常见电极的标准电极电势(25 ℃)
电极(氧化态/还原态) | 电极过程 | φ-/V |
Li+/Li | Li++e- | -3.045 |
K+/K | K++e- | -2.924 |
Ca2+/Ca | Ca2++2e- | -2.76 |
Na+/Na | Na++e- | -2.7109 |
Mg2+/Mg | Mg2++2e- | -2.375 |
Al3+|Al | Al3++3e- | -1.706 |
Zn2+/Zn | Zn2++2e- | -0.762 8 |
Fe2+/Fe | Fe2++2e- | -0.409 |
Ni2+/Ni | Ni2++2e- | -0.23 |
Sn2+/Sn | Sn2++2e- | -0.1364 |
Pb2+/Pb | Pb2++2e- | -0.126 3 |
H+/H2 | 2H++2e- | 0.00 |
Sn4+/Sn2+ | Sn4++2e- | +0.15 |
Cu2+/Cu | Cu2++2e- | +0.3402 |
O2/OH- | H2O+ | +0.401 |
Cu+/Cu | Cu++e- | +0.522 |
I2/I- | I2+2e- | +0.535 |
O2/O22- | O2+2H++2e- | +0.682 |
Fe3+/Fe2+ | Fe3++e- | +0.770 |
Ag+/Ag | Ag++e- | +0.799 6 |
Br2/Br- | Br2+2e- | +1.087 |
Cl2/Cl- | Cl2+2e- | +1.358 3 |
S2O82-/SO42- | S2O82-+2e- | +2.0(+2.05) |
F2/F- | F2+2e- | +2.87 |
φ-值的大小标志着还原态物质在溶液中失去电子转变为氧化态物质的难易程度。φ-值越负,说明该电对中还原态物质失电子的能力越强,是强还原剂,其对应的氧化态物质氧化能力越弱;φ-值越正,说明该电对中氧化态物质得电子的能力越强,是强氧化剂,其对应的还原态物质还原能力越弱。表中物质Li是最强的还原剂,F2是最强的氧化剂。
氧化还原反应总是在得电子本领强的氧化剂和失电子本领强的还原剂间发生,换言之,较强的氧化剂和较强的还原剂相互反应而生成较弱的还原剂和较弱的氧化剂。因此,利用电极电势可以判断氧化还原反应进行的方向。
从在标准电极电势表上的位置来看,右上方的还原剂跟左下方的氧化剂能自发地发生氧化还原反应。例如,判断Sn2++2Fe3+=Sn4++2Fe2+的反应能否自发地向右进行时,我们发现Sn2+是还原剂,Fe3+是氧化剂,查表得:
Sn4++2e-![]() Sn2+φ-=+0.15 V
Sn2+φ-=+0.15 V
Fe3++e-![]() Fe2+φ-=+0.770 V
Fe2+φ-=+0.770 V
电极电势代数值小的电对中的还原态物质是较强的还原剂,而电极电势代数值大的电对中的氧化态物质是较强的氧化剂,所以反应可以进行。反之,以Sn4+为氧化剂,Fe2+为还原剂,反应就不能进行。
必须注意的是,电极电势可以说明氧化还原反应能否进行,但它却不能说明反应的速率。例如,用氧气氧化氢气的电对的电势差(1.23 V)是足够大的,反应能够进行,但在室温下,这个反应的速率小得不能量度,只有在升高温度或加入催化剂时才能使反应速率增大。

- 全部评论(0)
