用标准电极电势定量计算各种平衡常数
时间:2022-08-25 16:25 来源:未知 作者:黄瑞 点击: 次 所属专题: 电极电势 溶度积 电离平衡常数 水的离子积
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、水的离子积计算
水的离子积(Kw)是一个使用频率较高的化学数据。而一个电极反应只要其中有H+离子或OH-离子,在用能斯特方程讨论其酸性介质及碱性介质中的标准电极电势间的关系时,其中就必然会有Kw项。就都可以用来计算Kw值。当然,最为简单(涉及的数据最少)的还是H2电极或O2电极。
这里仅以H2电极为例,进行一下这个计算。
例1,已知酸性介质中2H++2e-=H2的Φo(H+/H2) = 0 V,而碱性介质中2H2O+2e-=H2+2OH-的Φo(H2O/H2) = -0.828 V。
解:对酸性介质中的电极反应,有能斯特方程
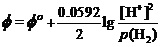
用如上的能斯特方程,讨论其碱性介质中电极电势时,应将其中的[H+]改写为Kw/[OH-]。即
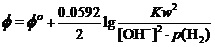 。
。
这样,只要将标准状态时[OH-]= 1.000 mol•L-1 p(H2)=1.000 atm,Φo(H2O/H2) = -0.828 V,代入上式。就有
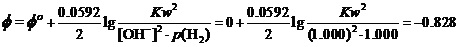
据上式的右端两项可解出,在298K时Kw=1.03×10-14。
二、弱酸的解离常数
对有氧化性或还原性的一元弱酸来说,只要知道其酸性介质标准电极电势值(ΦoA)及对应的碱性介质中的标准电极电势(ΦoB)值,就可以求出其解离常数。如:
例2,已知酸性介质中HClO+H++2e-=Cl-+H2O的Φo(HClO/Cl-) = 1.49 V,而碱性介质中ClO-+H2O +2e-=Cl-+2OH-的Φo(ClO-/Cl-) = 0.89 V。
解:对酸性介质中的电极反应,有能斯特方程
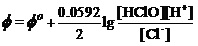
溶液中始终有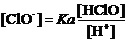 及[OH-]=Kw/[H+]。为描述碱性介质中的该电极反应,应将上式写为
及[OH-]=Kw/[H+]。为描述碱性介质中的该电极反应,应将上式写为
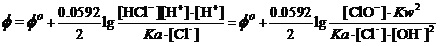 。
。
将标准状态时碱性介质中[OH-]、[ClO-]及[Cl-]均为1.000 mol•L-1,Kw=1.0×10-14,及Φo(ClO-/Cl-) = 0.89 V,可解出,在298K时HClO的Ka=1.86×10-8。
三、难溶氢氧化物的溶度积
用酸性介质中某金属离子的标准电极电势值(ΦoA)及碱性介质中该难溶氢氧化物的标准电极电势(ΦoB)值,就可以求出该氢氧化物的溶度积。如:
解:对酸性介质中的电极反应,有能斯特方程
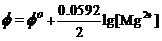
考虑到Ksp = [Mg2+][OH-]2,即[Mg2+] =Ksp/ [OH-]2。故上式可写为
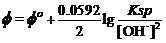 。
。
将标准状态时碱性介质中[OH-]为1.000 mol•L-1,Φo(Mg2+/ Mg)= -2.372V及Φo(Mg(OH)2/ Mg)= -2.69 V
代入上式。有
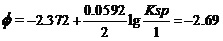 。
。
据上式的右端两项可解出,在298K时Mg(OH)2的Ksp=1.81×10-11。
四、难溶盐的溶度积
用某金属离子的标准电极电势值(ΦoA)及该离子的某难溶盐的标准电极电势(ΦoA)值,就可以求出该难溶盐的溶度积。如:
例4,已知Ag++e-= Ag的标准电极电势值Φo(Ag+/Ag)=0.7999V,AgCl +e-= Ag + Cl-的Φo(AgCl/Ag)=0.2223 V。计算AgCl的Ksp。
解:对简单电极反应有能斯特方程
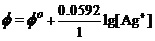 。
。
考虑到Ksp = [Ag+][Cl-],即[Ag+] =Ksp/ [Cl-]。故上式可写为
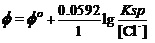 。
。
将难溶盐电极标准状态时[Cl-]为1.000 mol•L-1,Φo(Ag+/Ag)=0.7999V及Φo(AgCl/Ag)=0.2223 V
代入上式。有
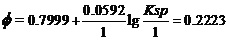 。
。
据上式的右端两项可解出,在298K时AgCl的Ksp=1.75×10-10。
五、配合物的稳定常数
用某金属离子的标准电极电势值(ΦoA)及该离子的某配合物的标准电极电势(ΦoA)值,就可以求出该配合物的稳定常数。如:
例5,已知Ag++e-= Ag的标准电极电势值Φo(AgCl / Ag)=0.7999V,Ag(NH3)2++e-= Ag + 2NH3的Φo(Ag(NH3)2+/ Ag)=0.373 V。计算Ag(NH3)2+的K稳。
解:简单电极反应,有能斯特方程
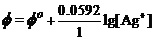 。
。
考虑到
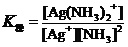 ,
,
即
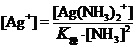
。故上式可写为
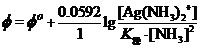
对配合物电极,将标准状态时[Ag(NH3)2+]、[NH3]为1.000 mol•L-1,Φo(Ag+/Ag)=0.7999V及Φo(Ag(NH3)2+/ Ag)=0.373 V
代入上式。有
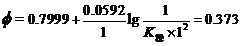 。
。
据上式的右端两项就可解出,在298K时Ag(NH3)2+的K稳=1.63×107。
六、水合离子的标准生成自由能
用某金属单质与其简单离子这个电对的标准电极电势值(ΦoA),与标准氢电极组成一个原电池,就可以求出该离子的生成自由能。如:
例6,已知Zn2++2e-= Zn的标准电极电势值Φo(Zn2+/Zn)= -0.7618V。计算Zn2+的标准生成自由能ΔFG°(Zn2+,aq)。
解:将这个电极与标准氢电极组成一个丹尼尔电池。当规定氢电极为负极时的反应为H2+Zn2+= 2H++ Zn,电池电动势为
E°=Φ°(+) -Φ°(-) =Φ°(Zn2+/Zn) -Φ°(H+/H2) = -0.7618-0=-0.7618(V)。
对一个化学反应来说,其自由能变与电池电动势的关系为ΔrG°= -nfE°。
即ΔrG°= -nFE°= -2×96.487×(-0.7618)=147.0 (KJ•mol-1)。
该反应的自由能变还可以被写为
ΔrG°=2×ΔFG°(H+,aq)+ ΔFG°(Zn,s)- ΔFG°(H2,g)- ΔFG°(Zn2+,aq)。
而作为稳定单质的ΔFG°(Zn,s)、ΔFG°(H2,g)都为0,而ΔFG°(H+,aq)也被规定为0。所以有ΔFG°(Zn2+,aq)=147.0 (KJ•mol-1)。
七、氧化还原反应的平衡常数
用反应的标准电动势与平衡常数间的关系,可进行反应平衡常数的计算。这样在已知反应物浓度的情况下,就可以计算出各种离子的平衡浓度了。如:
例7,已知Sn2++2e-= Sn的标准电极电势值Φo(Sn2+/Sn)= -0.1375V,Pb2++2e-= Pb的标准电极电势值Φo(Pb2+/Pb)= -0.1263V。计算Sn与Pb2+反应的平衡常数。
解1:Sn与Pb2+的反应为Sn +Pb2+= Sn2++Pb。在这个电池反应中Sn为负极。
其电池电动势为
E°=Φ°(+) -Φ°(-) =Φ°(Pb2+/Pb) -Φ°(Sn2+/Sn) = -0.1263-(-0.1376)= 0.0112(V)。
由ΔrG°= -nFE°=-2.303RTlgK。有
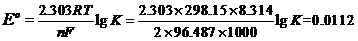 。
。
可解得K=2.39。
这是一个进行的并不完全的反应。平衡时[Sn2+]/[ Pb2+]=2.39,[Sn2+]只是体系中[ Pb2+]的2倍多一些。
也就是说,虽然在金属活动性顺序表中,Sn在Pb的前面。但是Sn也只能使约70%的Pb2+离子被置换出来。
解2:对反应Sn +Pb2+= Sn2++Pb。写出能斯特方程
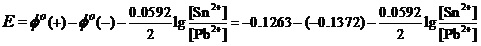 。
。
当反应达平衡状态时,有
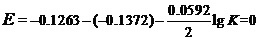 。
。
由此可得K=2.39。
解2的方法明显好于解1。因其公式涉及的常数少,常数的单位也无需再换算,不容易出错。
再讨论黄金不溶于浓盐酸的原因。
黄金溶于盐酸的过程应该是一个与其中氢离子反应的过程。考虑到2H++ 2e-=H2的Φo(H+/ H2)= 0V,这是一个比溶于硝酸还难进行的反应。
组合而成反应的平衡常数可计算为
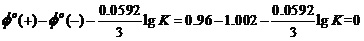 。
。
即反应的K= 7.4×10-3。
这个平衡常数不大,但也不很小,属于可逆反应的范畴。加之反应物浓度对平衡有很大的影响(反应物端物种的化学计量数之和为9),所以只要增大反应物浓度,反应就可以顺利正向进行。也就是说,黄金可溶于王水。

- 全部评论(0)
