常见物质的分离与提纯
时间:2016-01-15 13:01 来源:摘抄于因特网 作者:甑炳杨 点击:次 所属专题: 分离提纯
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物质的分离是把混合物中各物质经过物理(或化学)变化,将其彼此分开的过程,分开后各物质要恢复到原来的状态;物质的提纯是把混合物中的杂质除去,以得到纯物质的过程。在提纯中如果杂质发生化学变化,不必恢复为原来的物质。在进行物质分离与提纯时,应视物质及其所含杂质的性质选择适宜的方法。
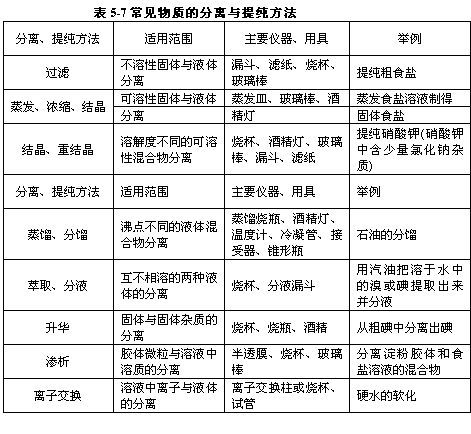
1.物质的分离与提纯常用的物理方法,见表5-7
说明:(1)过滤操作应注意做到“一角、二低、三接触”,如图5-18:
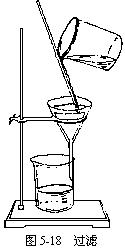
①“一角”:滤纸折叠的角度要与漏斗的角度(一般为60°)相符。折叠后的滤纸放入漏斗后,用食指按住,加入少量蒸馏水润湿,使之紧贴在漏斗内壁,赶走纸和壁之间的气泡。
②“二低”:滤纸边缘应略低于漏斗边缘;加入漏斗中液体的液面应略低于滤纸的边缘(略低约 1cm),以防止未过滤的液体外溢。
③“三接触”:漏斗颈末端与承接滤液的烧杯内壁相接触;使滤液沿烧杯内壁流下;向漏斗中倾倒液体时,要使玻璃棒一端与滤纸三折部分轻轻接触;承接液体的烧杯嘴和玻璃棒接触,使欲过滤的液体在玻棒的引流下流向漏斗。过滤后如果溶液仍然浑浊,应重新过滤一遍。如果滤液对滤纸有腐蚀作用,一般可用石棉或玻璃丝代替滤纸。如果过滤是为了得到洁净的沉淀物,则需对沉淀物进行洗涤,方法是:向过滤器里加入适量蒸馏水,使水面浸没沉淀物,待水滤去后,再加水洗涤,连续洗几次,直至沉淀物洗净为止。
(2)蒸馏操作应注意的事项,如图5-19:
①蒸馏烧瓶中所盛液体不能超过其容积的2/3,也不能少于1/3;
②温度计水银球部分应置于蒸馏烧瓶支管口下方约0.5cm处;
③冷凝管中冷却水从下口进,上口出;
④为防止爆沸可在蒸馏烧瓶中加入适量碎瓷片;
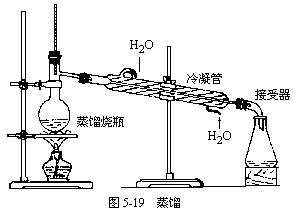
⑤蒸馏烧瓶的支管和伸入接液管的冷凝管必须穿过橡皮塞,以防止馏出液混入杂质;
⑥加热温度不能超过混合物中沸点最高物质的沸点。
将蒸馏原理用于多种混溶液体的分离,叫分馏,分馏是蒸馏的一种。
蒸馏与蒸发的区别:加热是为了获得溶液的残留物(浓缩后的浓溶液或蒸干后的固体物质)时,要用蒸发;加热是为了收集蒸气的冷凝液体时,要用蒸馏。
(3)蒸发操作应注意的事项:注意蒸发皿的溶液不超过蒸发皿容积的2/3;加热过程中要不断搅拌,以免溶液溅出;如果蒸干,当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。
(4)通常采用的结晶方法有
(以分离NaCl和KNO3的混和物为例):
①蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。例如:当NaCl和 KNO3的混合物中NaCl多而KNO3少时,即可采用此法,先分离出NaCl,再分离出KNO3。
②降温结晶:先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。例如:当NaCl和KNO3的混合物中KNO3多而NaCl少时,即可采用此法,先分离出KNO3,再分离出NaCl。
(5)萃取的操作方法如下:
①用普通漏斗把待萃取的溶液注入分液漏斗,再注入足量萃取液;②随即振荡,使溶质充分转移到萃取剂中。振荡的方法是用右手压住上口玻璃塞,左手握住活塞部分,反复倒转漏斗并用力振荡;③然后将分液漏斗置于铁架台的铁环上静置,待分层后进行分液;④蒸发萃取剂即可得到
纯净的溶质。
为把溶质分离干净,一般需多次萃取。
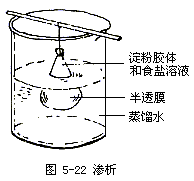
(6)分液的操作方法如图5-20~图5-22:

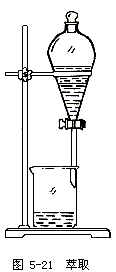
①用普通漏斗把要分离的液体注入分液漏斗内,盖好玻璃塞;
②将分液漏斗置于铁架台的铁圈上,静置,分层;
③将玻璃塞打开,使塞上的凹槽对准漏牛口上的小孔再盖好,使漏斗内外空气相通,以保证漏斗里的液体能够流出;
④打开活塞,使下层液体慢慢流出,放入烧杯,待下层液体流完立即关闭活塞,注意不可使上层液体流出;
⑤从漏斗上端口倒出上层液体。
(7)渗析的操作方法如下:将欲提纯或欲精制的胶体溶液放入半透膜袋中,用细绳把袋口扎好,系在玻棒上,然后悬挂在盛蒸馏水的烧杯中(半透膜袋要浸入水中),胶体溶液中的分子或离子就会透过半透膜进入蒸馏水中。悬挂的时间要充分,蒸馏水要换几次,直至蒸馏水中检查不出透过来的分子或离子为止,如图5-22。例如:把淀粉胶体里的食盐分离出去,即采用渗析方法。
2.化学方法提纯和分离物质的“四原则”和“三必须”
(1)“四原则”是:一不增(提纯过程中不增加新的杂质);二不减(不减少欲被提纯的物质);三易分离(被提纯物与杂质容易分离);四易复原(被提纯物质要复原)。
(2)“三必须”是:一除杂试剂必须过量;二过量试剂必须除尽(因为过量试剂带入新的杂质);三除杂途径选最佳。
3.无机物提纯一般采用的化学方法
(1)生成沉淀法:例如NaCl溶液中混有 MgCl2、CaCl2杂质,可先加入过量的NaOH,使Mg2+转化为Mg(OH)2沉淀而除去(同时引入了OH-杂质);然后加入过量的Na2CO3,使
 HCl),并调节溶液的pH值至中性即可。
HCl),并调节溶液的pH值至中性即可。
(2)生成气体法:例如Na2SO4溶液中混有少量Na2S2O3,为了增

(3)氧化还原法:例如FeCl2溶液里含有少量FeCl3杂质,可加过量铁粉将Fe3+除去(Fe+2Fe3+====3Fe2+)。
如在FeCl3溶液中含有少量FeCl2杂质,可通入适量Cl2将FeCl2氧化为FeCl3(2Fe2++Cl2====2Fe3++2Cl-)。
(4)利用物质的两性除去杂质:如在镁粉中混有少量铝粉,可向其中加入足量的NaOH溶液,使其中的Al转化为可溶性的NaAlO2,然后过滤,即可得到纯净的Mg(2Al+2OH-+2H2O====2AlO2-+3H2↑)。
(5)正盐与酸式盐的相互转化:例如在Na2CO3溶液中含有少量NaHCO3杂质,可用加热法使NaHCO3分解成Na2CO3而除去(2 NaH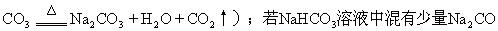
3,可通入足量的CO2使Na2CO3转化为NaHCO3(CO32-+H2O+CO2====2HCO3-)。
(6)离子交换法(略)。
4.有机物的分离与提纯
有机物的分离是利用混合物各成分的密度不同、熔沸点不同、对溶剂溶解性的不同等,通过过滤、洗气、萃取、分液、蒸馏(分馏)、盐析、渗析等方法将各成分一一分离。
有机物的提纯是利用被提纯物质的性质(包括物性和化性)的不同,采用物理方法和化学方法除去物质中的杂质,从而得到纯净的物质。在有机物的提纯中也必须遵循“四原则”和“三必须”。
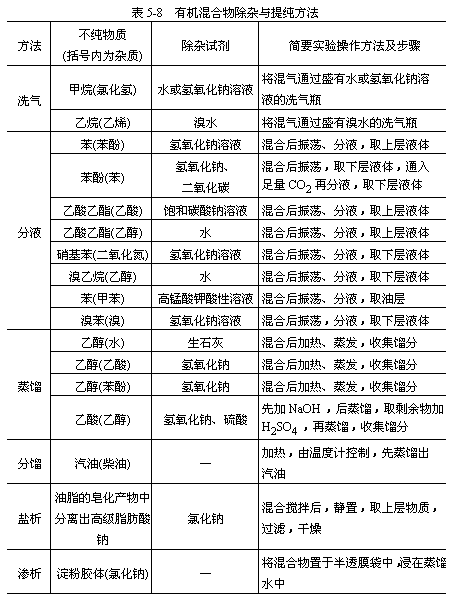
现将不同有机混合物除杂与提纯的方法及实例,列表比较如下(见表5-8)。

- 全部评论(0)
