用平均式法巧解化学计算题
时间:2020-02-28 15:32 来源: 作者:易友生 点击:次 所属专题: 平均值法 化学计算方法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
平均式法是高低求中类计算问题的一种求混合物组成的方法。利用高低求中原理以确定平均式,从而求得混合物中各物质的分子式。这种解法的解题思路和过程有两种:第一种是首先求出平均相对分子质量,找出小于平均值的一种物质,然后再通过计算确定另一种物质及百分含量,用同一性原理检验是否符合题意。第二种是首先求出平均式,然后用居中性原理确定混合物可能出现的组合情况,用同一性原理检验这些组合情况的合理性,用求和公式变式或三角正弦法、或十字交叉法以确定符合题意的每一组合的各物质有关量。
例1.有两种气态烃20 mL,与过量氧气反应后生成40 mL二氧化碳和30 mL水蒸气(体积在相同条件下测定,且温度≥100℃)。求混合烃的物质的量组成。
解析:根据相同条件下,气体的体积比即为化学计量数之比,可得出如下化学方程式:CxHy+kO2 ® 2CO2+3H2O
由此可求得该混合烃的平均式为C2H3。按照居中性原理,C原子数可都为2,或一种为1,一种大于2;H原子数只有一种情况:一种小于3,一种大于3。
一般情况下,我们认为的气态烃为碳原子数小于4的烃(即不包括新戊烷,这是过去题的叙述和含意,现在的题则准确地叙述为:碳原子数小于4的烃)有:
CH4 C2H6 C3H8 C4H10 C2H4 C2H6 C4H8 C2H2 C3H4 C4H6
从C原子考虑,CH4可与C3、C4的烃组合出6种,C2的烃可相互组合出3种。这样问题弄得很复杂。若从H原子考虑则颇为简单,因为甲烷和碳原子数为3、4的烃,其氢原子数皆大于3,这些组合都不符合题意。而H原子数小于3的只有C2H2,再结合碳原子看,可得出两种组合:C2H4和C2H2和C2H6和C2H2。
由氢原子数的三角正弦,可得出它们的物质的量组成:

答:(1) C2H4和C2H2各占50% (2) C2H2占75%,C2H6占25%
注意:在求平均式建立烃的化学方程式时,不必用CxHy+(x+![]() )O2 ® xCO2+
)O2 ® xCO2+![]() H2O(g),而应直接代入相应的数字。由于计算烃的平均式时不需要氧气的数据,故可令O2的化学计量数为任意符号,如上面令为k。
H2O(g),而应直接代入相应的数字。由于计算烃的平均式时不需要氧气的数据,故可令O2的化学计量数为任意符号,如上面令为k。
例2.某混合气体由两种气态烃组成,取2.24 L该混合气体完全燃烧后得到4.48 L二氧化碳(气体体积都已折算为标准状况)和3.6 g水。则这两种气体可能是 ( BE )
A. CH4和C3H8 B. CH4和C3H4 C. C2H4和C3H4
D. C2H4和C2H6 E. C2H2和C2H6 (92年上海高考题28)
解析:标准状况下,气体2.24 L为1 mol,4.48 L为2 mol;水3.6 g为2 mol。根据化学方程式中,各物质的物质的量之比即为化学计量数之比,可得出如下化学方程式:
CxHy+kO2 ® 2CO2+3H2O
由此可求得该混合烃的平均式为C2H3。按照居中性原理,C原子数可都为2,或一种为1,一种大于2;H原子数只有一种情况:一种小于3,一种大于3。B、E选项符合题意。
例3.常温下,一种烷烃A和一种单烯烃B组成的混合气体,A与B分子中最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1) 将1 L该混合气体充分燃烧,在同温同压下得到2.5 L CO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
组合编号 | A的分子式 | B的分子式 | A和B的体积比(VA∶VB) |
(2) 120℃时取1 L该混合气体与9 L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%。试通过计算确定A和B的分子式。 (MCE91.42)
解析:(1) 1 L碳原子数为n的烷烃或烯烃充分燃烧后均得到n L CO2。由题意1 L该混合气体充分燃烧后生成2.5 L CO2,且B分子的碳原子数比A分子的多,可推断此混合气体只能由碳原子数小于2.5的烷烃( CH4和C2H6)和碳原子数大于2.5的烯烃( C3H6和C4H8)组成。它们有4种可能的组合。可根据每一组合中烷烃和烯烃的碳原子数,按三角正弦法确定A和B的组成。如:
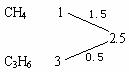
即的体积比为0.5∶1.5=1∶3。
则① CH4∶C3H6:1∶3 ② CH4∶C4H8:1∶1 ③ C2H6∶C3H6:1∶1 ④ C2H6∶C4H8:3∶1
(2) 因O2过量,设燃烧的混合烃为CxHy,耗O2的体积为z。
CxHy+zO2 ® 2.5CO2+![]() H2O(g)
H2O(g)
由氧原子数相等关系得:2z=2.5×2+![]() ,
,
整理为:4z-y=10 ①
由差量得: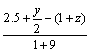 =6.25%,
=6.25%,
整理得:-2z+y=-1.75 ②
联立①②式解得y=6.5,x=2.5。即混合烃的平均式为:C2.5H6.5,则为上述4组中的第2组和第4组。按同一性原理,由烷烃和烯烃的氢原子数可得出其体积比,第4组仍为3∶1,为该题的解;第2组为3∶5,与碳原子数所得的体积比1∶1不相符,应舍去。即A为C2H6,B为C4H8。
答案:(1)
组合编号 | A的分子式 | B的分子式 | A和B的体积比(VA∶VB) |
① ② ③ ④ | CH4 CH4 C2H6 C2H6 | C3H6 C4H8 C3H6 C4H8 | 1∶3 1∶1 1∶1 3∶1 |
(2) A:C2H6 B:C4H8
例4.两种气态链烃各0.1 mol组成的混合物,与过量氧气混合后充分燃烧,燃烧后的产物通过浓硫酸时,溶液质量增加7.2 g;再通过氢氧化钠溶液时,溶液质量增加17.6 g。在下列混合物中:① 烷烃与烷烃;② 烷烃与烯烃;③ 烷烃与炔烃;④ 烯烃与烯烃;⑤ 烯烃与炔烃;⑥ 炔烃与炔烃,符合上述情况的是 ( C )
A. ④ B. ④、⑤ C. ③ D. ①、⑥
解析:由0.1 mol的混烃燃烧生成0.4 mol CO2和0.4 mol H2O,得平均式为C4H8,学生易认为③和④都对而多选A。因为含4个碳原子的烯烃只有C4H8,且5个碳原子数的烃不为气态烃,故不能选A。
例5.在压强为1.01×105 Pa、127℃下,由两种常见的有机物组成的混合气体20 mL跟同状态下的25 mL O2混合,引燃恰好使有机气体完全燃烧,所生成的二氧化碳和水蒸气构成的混合气体的平均分子量是28.4。当恢复到反应前的条件,混合气体的密度比点燃前的混合气体(含O2)的密度减少了![]() 。试问原混合气体的组成有哪些可能?每种可能中,各组成的体积分数是多少?
。试问原混合气体的组成有哪些可能?每种可能中,各组成的体积分数是多少?
解析:燃烧后,已知平均相对分子质量,由三角正弦可得出CO2与水蒸气的物质的量(或体积比)为2∶3,后来混合气体的体积为45 mL×![]() =50 mL。其中:V(CO2)=20 mL,V(H2O)=30 mL,
=50 mL。其中:V(CO2)=20 mL,V(H2O)=30 mL,
解一:用平均式求解。设平均式为CxHyOz,
4CxHyOz+5O2 ® 4CO2+6H2O
x=1,y=1,z=1,平均分子式为CH3O,只能是一碳化物。一碳化物有:CH4、CH4O、CH2O、CH2O2。按照居中性原理,从氧原子考虑,只能有两种组合:
CH4 CH2O
CH2O2 CH4O
由氢原子数或氧原子数可知两组中各成分皆占50%。
解二:用代数方程求解:
设A为x mL,B为20-x mL。
Ax+(20-x)B+25O2 ® 20CO2+30H2O
若A、B为二碳化物,则等式不成立:2x+2(20-x)≠20,即等式两端碳原子数不等。
若A、B为一碳化物:x+20-x=20,,则等式成立。
一碳化物有:CH4、CH4O、CH2O、CH2O2。当各占50%时有以下两种组成符合题意。
答:(1) CH4 50% HCOOH 50% (2) CH3OH 50% HCHO 50%
例6.将0.1 mol两种气态烃组成的混合气完全燃烧后得到3.36 L(标准状况)CO2和3.6 g H2O。下列说法正确的是 ( BD )
A. 一定有乙烯 B. 一定有甲烷 C. 一定没有甲烷 D. 一定没有乙烷
解析:烃、C、H之比为1∶1.5∶4,平均式为C1.5H4,故必有甲烷,同时另一种烃含碳原子数大于1,且含有4个H原子。
例7.由C、H、O三种元素组成的两种有机物A和B按等物质的量混合。取1 mol混合物完全燃烧,需要O2 3.5 mol,生成CO2 2.5 mol,且知A分子中的氢原子数是B分子中氢原子数的两倍。求A、B可能有的分子式。
解析:因为燃烧时1 mol C原子耗1 mol O2,4 mol H原子耗1 mol O2。现CO2 2.5 mol耗2.5 mol O2,剩1 mol O2需4 mol H原子。故可得平均式为C2.5H4(H2O)x。
讨论:当x=1时,平均组成为C2.5H6O,有两种组合符合:C3H8O和C2H4O,C4H8O和CH4O。当x=2时,平均式为C2.5H8O,不符合烃类衍生物的组成,故舍去。
例8.A为烃、B为烃的含氧衍生物。由等物质的量的A和B组成的混合物0.05 mol在0.125 mol的氧气中完全燃烧,生成0.1 mol CO2和0.1 mol H2O。试通过计算回答:
(1) 从分子式角度看,该混合物组成有几种可能,写出各组混合物的分子式。
(2) 另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定;
① 若耗氧量一定,则A、B的分子式分别是 、 。
② 若生成的CO2、H2O的物质的量一定,则A、B的分子式分别是 、 。
(3) 另取a mol 的任意比混合的A和B的混合物,在过量的氧气中完全燃烧。
① 若耗氧量为定值,则该值为 mol(用含a的代数式表示)。
② 若生成物CO2的物质的量为定值,则生成物水的质量范围为 。
解析:2CxHyOz+5O2 ® 4CO2+4H2O,平均式为C2H4O
a 2.5 a
最大:CxH6Oz ® 3H2O 最小:CxH2Oz ® H2O
a 3a a a
答案:(1) CH4和C3H4O2;C2H6和C2H2O2;C2H4和C2H4O2;C2H2和C2H6O2;C3H6和CH2O2;CH4O和C3H4O (2) ①C2H2; C2H6O2 ② C2H4;C2H4O2 (3) ① 2.5 a ② (18 a ~54 a ) g
例9.在常温常压下,将1L mL H2、CH4、C2H2的混合气体与足量O2混合点燃,经充分反应并恢复到相同状态下,测得总体积减少26 mL。求原混合气体中CH4的体积为多少毫升?
解析:可将H2、C2H2写为CnH2,通过差值公式可求混合物CxHy中平均氢原子数。
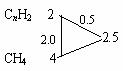
16(1+![]() )=26,y=2.5,
)=26,y=2.5,
CH4:16 mL×![]() =4 mL
=4 mL
答:CH4的体积为4 mL。
用平均式法确定混合物的组成,要根据条件进行检验,其中,以利用同一性原理来判断则较为简捷。

- 全部评论(0)
