差量问题的计算
时间:2016-01-09 21:41 来源: 作者:何立功 点击:次 所属专题: 差量法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
差量问题是指存在某种量的差值并能利用此差量进行计算的问题。差量可以是质量差、物质的量差、气体体积差、百分率差和溶解度差。它包括:① 固体残余物的计算,② 有关气体分析的计算,③ 溶液质量增加或减少的计算,④ 改变温度时晶体析出量和溶解量的计算,⑥ 利用差量判断过量。其解法有:① 比例差量法,② 代数差量法,③ 摩尔差量法。
数学中的比例是化学方程式计算的一种方法,而等比定理则是差量计算的依据。
![]() =
=![]() =
=![]() ,
,![]() =
=![]() =
=![]() =
=![]()
例1.将质量为5.000 g的铜片浸入100 mL 0.05 mol / L的硝酸银溶液中,待反应停止后,取出铜片,洗净干燥后,称量覆有银的铜片质量是5.304 g。问:
(1) 铜片表面的银有多少克?
(2) 若反应后溶液质量仍是100 mL,则该溶液中硝酸银溶液的物质的量浓度是多少?Ag+的物质的量浓度是多少?
解析:由于铜片与硝酸银溶液反应置换的银覆盖在铜片上,阻止了铜与硝酸银的进一步反应,因此,5.000 g铜与100 mL 0.05 mol / L的硝酸银溶液均未完全反应。
解法一:比例差量法。设析出银的质量为x ,生成Cu(NO3)2的物质的量为y,参加反应的AgNO3的质量为z。
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag D m
64 g 2 mol 1 mol 216 g 216 g-64 g = 152 g
z y x 5.304 g-5.000 g = 0.304 g
![]()
![]()
![]()
Cu(NO3)2溶液的浓度为![]()
溶液中尚剩Ag+:![]()
解法二:代数差量法。设析出银的物质的量为2x
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag D m
x 2x x 2x 5.304 g-5.000 g = 0.304 g
2x×108 g-64x = 0.304 g, 2x = 0.004 mol
析出银:0.004 mol×108 g / mol =0.432 g
Cu(NO3)2溶液的浓度为![]()
溶液中尚剩Ag+:![]()
解法三:摩尔差量法。可以认为按化学方程式的化学计量数关系所得的理论差值为1 mol,即2×108 g-64 g = 152 g。则实际差值的物质的量为![]() 。由此可以得出化学方程式中任何物质的物质的量。
。由此可以得出化学方程式中任何物质的物质的量。
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag D n
0.002 0.004 0.002 0.002 0.002
以下计算过程同上,略。
由以上的三种解法可以看出,最后一种解法最简单,但理解起来较难一些。
下面列出有关计算的化学反应的差量:
(1) Fe+CuSO4=FeSO4+Cu Dm
56 64 64-56=8(可理解为固体质量增加或溶液质量减少)
(2) 2NaHCO3![]() Na2CO3 +CO2+H2O Dm
Na2CO3 +CO2+H2O Dm
44 18 44+18=62
(3) 2Na2O2+2CO2=2Na2CO3+O2 Dm
44×2 32 88-32=56
(4) 2Na+2H2O=2NaOH+H2↑ Dm
23×2 2 46-2=44
(5) 2K+2H2O=2KOH+H2↑ Dm
39×2 2 78-2=76
(6) Cl2 + 2KI= 2KCl + I2 Dm
36.5×2 127×2 254-71=183
Cl2 + 2NaI= 2NaCl+ I2 Dm
36.5×2 127×2 254-71=183
(7) Cl2 + 2KBr = 2KCl + Br2 Dm
36.5×2 80×2 160-71=89
Cl2 + 2NaBr= 2NaCl + Br2 Dm
103×2 58.5×2 206-117=89
(8) KX + AgNO3 = KNO3 + AgCl¯ Dm
39 108 108-39=69(沉淀比卤化钾增加的质量)
(9) BaCO3+2HCl=BaCl2+H2O+CO2 Dm
60 71 11
例2.加热3.24 g Na2CO3和NaHCO3的混合物至质量不再变化,剩余固体的质量为2.51 g。计算原混合物中Na2CO3的质量分数。(高一新教材p35.四.2)
解法一:2NaHCO3![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2
可把H2O+CO2看成H2CO3,
n(H2O+CO2)=![]() =
=![]() =
=![]() =
=![]() mol
mol
n(NaHCO3)=2×n(H2O+CO2)=2×![]() mol=
mol=![]() mol
mol
m(NaHCO3)=n(NaHCO3)×M(NaHCO3)=![]() mol×84 g / mol=1.978 g
mol×84 g / mol=1.978 g
Na2CO3%=![]() ×100%=38.95%
×100%=38.95%
解法二:利用差量关系解题。设原混合物中NaHCO3的物质的量为x,
2NaHCO3![]() Na2CO3+H2O+CO2 Dn
Na2CO3+H2O+CO2 Dn
2x x x x (18 g / mol+44 g / mol )x=3.24 g-2.51 g
62x=0.73 g, 2x=![]() mol,以下同解一。
mol,以下同解一。
解法三:代数法。设原混合物中NaHCO3和Na2CO3的物质的量各为x、y,
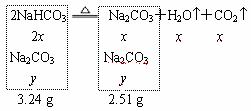
2x×84 g / mol+y×106 g / mol=3.24 g
x×106 g / mol+y×106 g / mol=2.51 g
x(168-106) g / mol=3.24 g-2.51 g (这也是差量关系的计算方法)
2x=![]() mol,以下同解一。
mol,以下同解一。
答:碳酸钠为38.9% 。
例3.(MCE99.32)取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470 g。冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486 g。
(1) 写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
(2) 计算燃烧所得混合物中氮化镁的质量分数。
5. (1) Mg3N2+6H2O=2NH3+3Mg(OH)2
(2) 解法一:设原混合物中Mg3N2的质量为x,由Mg3N2生成的MgO的质量为y。
Mg3N2 ----- 3MgO
100 120
x y
y=![]() ,(0.470 g-x)+
,(0.470 g-x)+![]() =0.486 g ,x=0.080 g ,
=0.486 g ,x=0.080 g , ![]() =17%
=17%
解法二:
![]() =
=![]()
m(Mg3N2)=0.080 g , ![]() =17%
=17%
解法三:代数差量法
Mg3N2+6H2O=2NH3+3Mg(OH)2
3Mg(OH)2=3MgO+6H2O
Mg3N2+3H2O=2NH3+3MgO Dm
x 3x 2x x 0.486 g-0.470 g
3x×40 g / mol-x×100 g / mol=0.486 g-0.470 g
或:3x×18 g / mol-2x×17 g / mol=0.486 g-0.470 g
例4.16.6 g卤化银跟足量的AgNO3反应生成23.5 g沉淀,该卤化钾的化学式是 ( D )
A. KF B. KCl C. KBr D. KI(教学与测试p50.10)
解析:设卤化钾的物质的量为x,
KX + AgNO3 = KNO3 + AgCl¯ Dm
39x 108x (108-39)x=69x
(108-39)g / mol×x=23.5 g-16.6 g=6.9 g, 69 g / mol×x=6.9 g,x=0.1 mol,
M(KX)=![]() =166 g / mol,即KX的相对分子质量为166,
=166 g / mol,即KX的相对分子质量为166,
X的相对原子质量为:166-39=127,为碘元素,KX为KI。
例5.在密度为1.4 g / cm3浓度为15 mol / L的过量HNO3溶液100 mL中,投入一小块铜片,待反应完全后,溶液质量为136 g,则投入Cu的质量是 ( C )
A. 3.2 g B. 6.4 g C. 9.143 g D. 8.72 g
解析:HNO3溶液质量为:100 mL×1.4 g / cm3 = 140 g。
Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O D m
64 x - 92 x = 136 g-140 g = -4 g
28 x = 4 g,x = ![]() mol,铜的质量为:
mol,铜的质量为:![]() mol ×64 g / mol = 9.143 g。应选C。
mol ×64 g / mol = 9.143 g。应选C。
例6.将盛有45 mL N2和NO2混合气体的试管倒放在水中,过一段时间后,气体体积变为35 mL,则原混合气体中N2和NO2的体积分别为 ( D )
A. 15 mL,30 mL B. 20 mL,15 mL
C. 35 mL,10 mL D. 30 mL,15 mL
解析:3NO2+H2O = 2HNO3+NO D m
3x - x = 2x = 45 mL-35 mL = 10 mL
3x = 15 mL(NO2),N2为45 mL-15 mL = 30 mL,故应选D。
例7.在一定量的BaCO3和BaSO4的混合物中,逐滴加入盐酸,直到CO2不再产生为止,蒸干后得到的固体质量比原来混合物质量增加2.79%,则原混合物中BaCO3的质量分数约为
( C )
A. 10% B. 20% C. 50% D. 63%
解析:BaCO3+2HCl=BaCl2+H2O+CO2 Dm
60 71 11
x 11x=2.79%
x=![]() , BaCO3%=
, BaCO3%=![]() ×197=50%
×197=50%
例8.一根铁棒100 g,插入100 g一定浓度的CuSO4溶液中,充分反应后取出烘干得100.8 g,则:
(1) 写出发生的反应方程式,指出被氧化的元素。
(2) 计算反应中被还原的物质的质量。
(3) 求该CuSO4溶液中溶质的质量分数。
解:(1) Fe+CuSO4=FeSO4+Cu,Fe被氧化。
(2) 设参加反应Fe的物质的量为x,则64 g / mol×x-56 g / mol×x=100.8 g-100 g,
8x=0.8 mol,x=0.1 mol,
被还原的物质是CuSO4,n (CuSO4)=n(Fe)=0.1 mol,
m (CuSO4)=0.1 mol×160 g / mol=16 g。
(3) w (CuSO4)=![]() ×100%=16%
×100%=16%
例9.现有Na2CO3和NaHCO3的混合物6.85 g,加热灼烧后再跟足量的盐酸反应,放出CO 2.2 g,试计算混合物Na2CO3和NaHCO3里各是多少g。
分析:
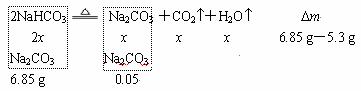
Na2CO3+2HCl=2NaCl+CO2+H2O
0.05 0.05
解:n (CO2)=![]() =0.05 mol,
=0.05 mol,
n (总Na2CO3)=n (CO2)=0.05 mol,
m (总Na2CO3)=0.05 mol×106 g / mol=5.3 g,
设反应的NaHCO3的物质的量为,反应前后的差量应为CO2与H2O蒸气质量之和。
44 g / mol×x+18 g / mol×x=6.85 g-5.3 g,x=0.025 mol,
m (NaHCO3)=0.025 mol×2×84 g / mol=4.2 g,
m (Na2CO3)=6.85 g-4.2 g=2.65 g。
例10.有20.4 g Na2O2被用作呼吸面具的供氧剂,经使用后,质量增至23.2 g,则吸收了CO2多少g?
解:设CO2的物质的量为2x,
2Na2O2+2CO2=2Na2CO3+O2 Dm
2x x 23.2 g-20.4 g
44 g / mol×2x-32 g / mol×x=23.2 g-20.4 g,2x=0.1 mol,
m (CO2)=0.1 mol×44 g / mol=4.4 g,
例11.今有Na2CO3、NaHCO3、NaCl组成的混合物100 g,加热到质量不再减少为止,剩下的残渣为84.5 g。取残渣8.45 g放入烧瓶, ,缓缓加入20 g盐酸(过量)至气体全部逸出后称量,全部溶液净重25.15 g。试计算原混合物中各物质的质量分数。(教学与测试p29.25)
解析:
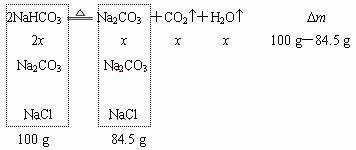
注意:由于从84.5 g残渣中取出8.45 g与盐酸反应,故可将后面的数据扩大10倍,以便于计算。

n(CO2)=![]() =0.75mol
=0.75mol
n(总Na2CO3)=n(CO2)=0.75mol,
m(总Na2CO3)=0.75mol×106 g / mol=79.5 g,
m(NaCl)=84.5 g-79.5 g=5 g
设NaHCO3的物质的量为2x,
44 g / mol×x+18 g / mol×x=100 g-84.5 g,x=0.25 mol,
m (NaHCO3)=0.25 mol×2×84 g / mol=42 g,
w (NaHCO3)=![]() ×100%=42%,
×100%=42%,
w (NaCl)=![]() ×100%=5%,
×100%=5%,
w (Na2CO3)=1-42%-5%=53%
答:NaHCO3为42%,NaCl为5%,Na2CO3为53%。
例12.将氯化钠和碘化钾的混合物20 g溶于水,通入足量氯气,然后将溶液蒸干并灼烧,待固体冷却后称量,质量为16.34 g。求原混合物中氯化钠、碘化钾各为多少克?(教学与测试p51.20)
解:设碘化钾的物质的量为2x,则Cl2、I2的物质的量为x,
Cl2 + 2KI= 2KCl + I2 Dm
x 2x 2x x 20 g-16.34 g
2x×166 g / mol-2x×74.5 g / mol=20 g-16.34 g或:x×254 g / mol-x×71 g / mol=20 g-16.34 g
183 g / mol×x=3.66 g,2x=0.04 mol,
m (KI)=0.04 mol×166 g / mol=6.64 g,
m (KCl)=20 g-6.64 g=13.36 g。

- 全部评论(0)
