平衡问题中等效与类比的应用
时间:2020-02-01 16:46 来源: 作者:郑益强 点击:次 所属专题: 等效法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、由此及彼的推断——平衡原理的迁移
【例1】 溶液中有化学平衡:A(aq)+2B(aq)![]() 2C(aq)+2D(aq)加水稀释,平衡移动,使D与B两种物质的浓度比的变化是( )
2C(aq)+2D(aq)加水稀释,平衡移动,使D与B两种物质的浓度比的变化是( )
A. 变大 B.变小 C.不变 D.不一定
【例2】 在硫化钠稀溶液中加入少量Na2S粉末,水解平衡S2ˉ+H2O![]() HSˉ+OHˉ将向________方向移动,恒温下蒸发水(不饱和),水解平衡将向_________方向移动。
HSˉ+OHˉ将向________方向移动,恒温下蒸发水(不饱和),水解平衡将向_________方向移动。
解析:水溶液中的化学平衡,加水稀释时平衡混合物各成分都得到稀释,与气体反应中的“减小压强”在实质上相同,平衡移动的方向也可类比判断为向微粒数增多的方向移动。显然例1的平衡向正反应方向移动。例2中,水虽然是反应物,但其作为稀溶液的溶剂,浓度非常接近于纯水,故稀释或浓缩中,水量变化对平衡的影响不在水的浓度变化而在溶液体积的变化。加入Na2S与蒸发水似乎都是增大浓度,其实不一样,加Na2S时,只增大S2-一种反应物浓度,而蒸发水时各离子的浓度都变大,前者符合勒夏特列原理的“增大反应物浓度”,而后者相当于 “加压”,使平衡向粒子数(水不应计算在内)减小的方向移动。
答案:例1 .A; 例2. 正反应;逆反应
二、“以物换物”的原则——等效投料
【例3】恒温下在一个密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g)
2C(g)
(1)若容器的容积可变,反应在恒压下进行。开始时放入物为1 mol A和3mol B(记为反应甲),结果到达平衡后,生成了a mol C,且C在平衡混合物中的体积分数为ε。若开始时放入0.5 mol A,x mol B和y mol C(记为反应乙),到达平衡后要使C在平衡混合中的体积仍为ε(A、B的体积分数也对应相等,下同)则x=__________, y=____________,平衡时C的物质的量是a的___________倍。
(2)若容器的容积恒定,开始时放入1mol A和3 mol B(记为反应丙),达到平衡后,C的体积分数也为ε,则容器的容积比反应甲的起始体积__________(选填 “大”、 “小”、 “相等”)。若开始时放入物是0.5 mol A,w mol B,z mol C(记为反应丁),达平衡后,C的体积分数仍为ε,则w =________, z = _________。
解析:相同的容器中发生的两次可逆反应,若起始物质的组成不相同,但最后的平衡态组成相同,则此两组起始物就是“等效投料”。等效投料的平衡过程常称为等效平衡。分恒容与恒压两种情况。判断两组起始物是否“等效”的方法是:
首先,根据化学方程式,把投料中的生成物假设完全发生逆反应而转化成反应物,并与直接投入的同种反应物的物质的量相加,作为该反应物的起始量。这一步简称之谓“转并”。
然后对不同次投料经“转并”后的“起始量”进行比较,得出是否“等效”的结论。
规律是:
对恒压容器(容积可变),只要两次投料中各物质的物质的量( “转并”后)之比相等,则平衡混合物的百分组成也相同。但这种“等效”的两平衡体系,混合物的总量并不相同,平衡总物质的量之比等于起始物质的量(“转并”后的)之比。
对恒容容器,则要求两次投料(转并后)完全相同才能使平衡态时混合物的百分组成相同。这时两平衡体系的总物质的量也相等。
本题(1)是恒压容器,为使反应甲、乙的投料比例相等,即乙的投料要符合n(A)∶n(B)= 1∶3,x应该取1.5 mol,而y可以是任意值。反应乙的投料总量(转并后)是反应甲的(y+1)/2倍,故平衡时C的物质的量是a的(y+1)/2倍。
本题(2)是恒容反应。由题可知,反应丙的平衡态与反应甲的平衡态完全相同,所以丙的容积应与甲的平衡体积相同。由于甲的容积在反应过程中是减小的,平衡时最小,故反应前比丙的容积大。反应丁的平衡和反应丙的平衡是恒容下的等效平衡,必符合投料(经转并后)完全相同的条件。故有n(z)=1 mol, n(w) = 1.5 mol
答案: (1) x=1.5 mol, y = 任意摩(一定范围) , (y+1)/2
(2) 小, w = 1.5 mol , z = 1 mol
三、 “殊途同归”的新路——等效途径替换
【例4】在一个恒容密闭容器中有化学平衡2NO2![]() N2O4,平衡混合物中物质的量之比n(N2O4 )/n(NO2)= x,保持温度不变,向平衡体系中再充入一定量纯NO2,重新达到平衡后比值n(N2O4 )/n(NO2)=y, 判断x和y的大小关系。
N2O4,平衡混合物中物质的量之比n(N2O4 )/n(NO2)= x,保持温度不变,向平衡体系中再充入一定量纯NO2,重新达到平衡后比值n(N2O4 )/n(NO2)=y, 判断x和y的大小关系。
解析:向平衡体系中充NO2,充入的NO2要发生一定程度的正向反应达到平衡,同时与原平衡体系产生互动,几个过程同时发生,相互影响,使情况显得很复杂。为了理清头绪,我们可以设想把组成复杂过程的各个简单过程分列出来,并按合理顺序依次单独进行,达到等效简化的目的。本题可设计由两个简单过程(如图I和II)组成的新途径来代替原过程:第一步先把要充入平衡体系的这部分NO2充到另一适当容积的容器B中,使其在温度、压强与原平衡体系A相同的条件下达到平衡,显然此时B中平衡混合物的浓度比n(N2O4 )/n(NO2)与A中相同,都为x。然后,将B中的平衡混合物全部压入A中,这一过程的变化为典型的“增大压强”,平衡向正反应方向移动,使y>x
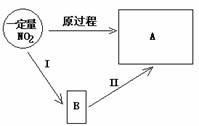
答案:x<y

- 全部评论(0)
