元素推断题的“题眼”
时间:2015-12-09 21:51 来源: 作者:胡中宇 点击:次 所属专题: 题眼 元素推断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、“题眼”是元素的性质
例1:A、B、C三种主族元素位于周期表相连续的三个不同的周期,原子序数C>A>B,其中B的次外层电子数为2。A的次外层电子数与B、C不同,A与B的族序数之和等于C的族序数。已知A的氢氧化物难溶于水,B的最高价氧化物对应水化物是种强酸。则A、B、C各为何元素?
解析:该题的“题眼”是元素B、A的性质,B的次外层电子数为2,且B的最高价氧化物对应水化物是种强酸,B为N;A的氢氧化物难溶于水,A与B的族序数之和等于C的族序数,A为Mg,C为Br。
元素的性质主要包括金属性、非金属性,微粒半径,主要化合价等等,如在前20号元素中,非金属性最强的是F,金属性最强的是K;原子半径最小的是H,F次之,最大的是K;最高价氧化物对应水化物酸性最强的是HClO4,HNO3、H2SO4也是强酸,碱性最强的是KOH,NaOH、Ca(OH)2也是强碱,呈两性的是Al(OH)3,气态氢化物最稳定的是HF,气态氢化物的水溶液酸性最强的是HCl等等。
二、“题眼”是最外层电子数
例:有A、B、C三种元素,A、B原子的电子层数相同,B、C原子的最外层电子数相同,又知这三种元素原子的最外层电子数之和为17,质子数之和为31。试通过计算确定这三种元素的名称。
解析:该题的“题眼”是最外层电子数。三种元素原子的最外层电子数之和为17,质子数之和为31,即内层电子数之和为14,A、B为第二周期元素,C为第三周期元素,最外层电子数平均为5.7,若B、C最外层电子数为5,分别为N、P,A为F;若B、C最外层电子数为6,分别为O、S,A为N;若B、C最外层电子数为7,分别为F、Cl,A为B;若B、C最外层电子数为8,分别为Ne、Ar,A为Li,满足题意的共有四组。若有其它条件限制再选择,如A、B、C三种元素中有一种是金属,满足的是Li、Ne、Ar;A、B、C三种元素在周期表中相邻,满足的是N、O、S。
三、“题眼”是特例元素
例3:A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,A与E同主族,B、C、D位于同周期。已知①除A外,其他各元素原子都有内层电子,其中B最外层电子数是次外层电子数的2倍;②A与B,B与C能生成气态分子X和Y;③D和E能生成离子化合物,且离子的电子层结构相同。试回答:(1)写出D与E形成化合物的电子式;(2)写出X、Y的电子式与结构式;(3)用电子式表示A与C原子形成分子的过程;(4)写出只含A、C元素的阴离子和阳离子。
解析:该题的“题眼”是特例元素,A无内层电子是H,B为C,然后根据题意不难得出,C为O,D为F,E为Na。
四、“题眼”是同电子数
例4:A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可能发生如下变化,且D与酸性氧化物、碱性氧化物均能反应。A+B=C+D,B+E=2D。请回答:(1)写出A的电子式;(2)写出B的化学式; (3)写出D的电子式。
解析:该题的“题眼”是A、B、C、D、E具有相同电子数,一般是10或18电子。A是由5个原子核组成的粒子,可能是CH4或![]() ,D与酸性氧化物、碱性氧化物均能反应是H2O。根据两个方程式得出:A为
,D与酸性氧化物、碱性氧化物均能反应是H2O。根据两个方程式得出:A为![]() ,B为
,B为![]() ,C为NH3,D为H2O,B为
,C为NH3,D为H2O,B为![]() 。
。
具有相同电子数的粒子有:
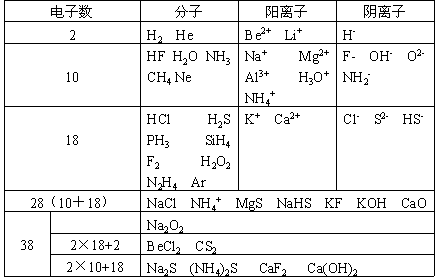
五、“题眼”是原子个数比
例5:A、B、C、D四种短周期元素原子序数依次增大。A、D同周期,B、C同周期。A、B组成化合物甲为气态,其中A、B原子个数比为4:1,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子个数比为1:1,丙为2:1,由D、C组成的化合物丁和戊都为固态,丁中D、C原子个数之比为1:1,戊中为2:1。写出:(1)甲、乙、丙、丁、戊的化学式;(2)写出B元素最高价氧化物与丁发生反应的化学方程式。
解析:该题的“题眼”是各化学式中原子个数比。甲为气态,其中A、B原子个数比为4:1,只有CH4。两种元素组成的不同化合物呈气态的有:SO2、SO3;CO、CO2;NO、NO2;CH4;液态有:H2O2、H2O;固态有:Na2O2、Na2O;FeS、FeS2;CuO、Cu2O。由此得出甲、乙、丙、丁、戊分别为CH4、H2O2、H2O、Na2O2、Na2O。

- 全部评论(0)
