溶液稀释与浓缩的有关计算
时间:2016-01-09 20:43 来源: 作者:邬兆宇 点击:次 所属专题: 溶液稀释 溶液混合
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【计算原理】
1、稀释前后溶液中所含溶质的质量、物质的量保持不变。
2、一般所说的稀释就是在较浓的溶液中,加入溶剂。同种溶质不同浓度溶液混合也是一种常见的稀释,相当于用稀溶液稀释浓溶液,混合溶液中溶质的总质量或总物质的量,等于混合前各溶液中溶质的质量或物质的量之和。
3、同种溶质不同浓度溶液混合时,质量可以直接相加,而密度不同的液体体积不能直接相加减。若要确定混合溶液的总体积,可以通过密度先求出混合溶液的总质量,再由混合溶液的密度求混合溶液的体积。
4、稀释与浓缩是相反的过程,计算原理相同。
【题型示例1】用质量分数为98%,密度为
[题析]这是一道典型的溶液稀释计算题,计算依据就是所取浓硫酸与所得稀硫酸中所含硫酸的质量或物质的量相等。
[计算步骤]
⑴500mL 2mol·L-1的稀硫酸n(H2SO4)=
⑵设含硫酸的物质的量为1mol 的浓硫酸的体积为V,则
(V×
[思考1]用题给数据能不能计算出所需水的体积?请说明理由。
【题型示例2】实验室中有密度为
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
[题析]两种不同溶液等体积混合时,混合后溶液体积不等于原溶液的体积和。
[题解]设原氨水体积为VmL,则原氨水质m(氨水)=0.91V g,所加水的质m(水)=
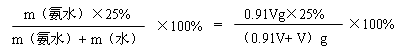
因为0.91V< V,所以结果应小于12.5%,故选择C
[思考2]若将题中“等体积”改成“等质量”,应该选哪个答案?能说明理由吗?
【题型示例3】一定量的14%KOH溶液,若将其蒸发掉
A. 2.2mol·L-1 B.4mol·L
[解法一]设原溶液质量为X,根据浓缩前后溶质质量不变,有X×14%=(X
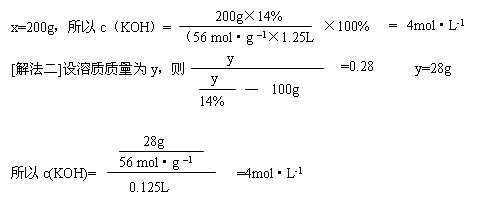
[思考3]还有没有其它解法?试一试
[思考1答案]不能。密度不同的液体体积不能相加减,只能通过稀、浓硫酸的质量差求出所需水的质量后,再由水的质量和密度才能求出所需水的体积,题中缺少稀硫酸的密度,故无法求出所需水的体积。实际应用中,配制一定物质的量浓度溶液时,是不需要计算所加水的体积的,只要计算出所需浓硫酸的体积后,直接加水稀释到所需体积就可以了。
[思考2答案]选A。因为溶质质量不变,加等质量水后,溶液质量变为原来的2倍,所以溶质质量分数即为原溶质质量分数的一半。

- 全部评论(0)
