过量计算问题归类解析
时间:2019-03-26 08:14 来源: 作者:孙艳芳 点击:次 所属专题: 过量计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、给出两种反应物的量,直接选量计算
这是最基本、最直接的过量问题,没有思维难度,只要按部就班严密解题即可。但应注意题目的综合分析,防止顾此失彼。
例1:21g铁粉与8g硫粉混合加热,若不考虑其他损失,可生成硫化亚铁a g;将上述反应后的固体混合物全部投入到足量的稀硫酸中,可得标况下V L气体。则a、V的数值分别为( )
(提示:![]() )
)
A. 33、8.4 B. 22、5.6 C. 29、8.4 D. 22、8.4
解析:根据题意![]()
由![]() 可知Fe过量,按S的量计算,
可知Fe过量,按S的量计算,![]() ,所以
,所以![]() 。产生的气体为
。产生的气体为![]() 和
和![]() 的混合气体,由于
的混合气体,由于![]() ,
,![]() ,标况下
,标况下![]() 。选D项。
。选D项。
此题容易误选B项,只顾前面的分析,忽略了后面的综合。
二、固体反应物过量导致酸浓度不够高,需定性判断
化学中的一些反应需要在高浓度下才能进行,当固体反应物过量时,随着反应的进行生成水而使溶液浓度降低,最终导致反应停止或发生其他反应。此时不能简单地选择不足量的物质进行计算,需要动态思维、定性判断。例如,Cu、Ag等金属与浓硫酸的反应;![]() 与浓盐酸的反应。若是Zn与浓硫酸的反应,随着浓度的下降则还原产物由
与浓盐酸的反应。若是Zn与浓硫酸的反应,随着浓度的下降则还原产物由![]() 变为
变为![]() ;而Cu与浓硝酸反应随着浓度的下降则还原产物由
;而Cu与浓硝酸反应随着浓度的下降则还原产物由![]() 变为NO等。
变为NO等。
例2:向![]() 的
的![]() 溶液中加入64g铜片并加热,被还原的
溶液中加入64g铜片并加热,被还原的![]() 的物质的量()
的物质的量()
A. 等于1.8 mol B. 等于1 mol C. 等于0.9 mol D. 小于0.9 mol
解析:显然Cu过量,若直接选量计算,则误选C项。依题意可知随着反应进行有水的生成而使![]() 溶液的浓度降低,
溶液的浓度降低,![]() 应小于0.9 mol。选D项。
应小于0.9 mol。选D项。
三、混合物与某物质反应的过量问题,需转化计算
涉及混合物与某物质反应的过量问题时,先将混合物抽象转化为单一成分,再判断计算。
例3:在25℃,101kPa条件下,将10 L ![]() 和
和![]() 的混合气体通入15 L
的混合气体通入15 L ![]() 中,使其完全燃烧,干燥后,恢复至原来的温度和压强,问:
中,使其完全燃烧,干燥后,恢复至原来的温度和压强,问:
(1)若剩余气体的体积为15L,则原CO和![]() 的混合气体中V(CO)=________L,V(
的混合气体中V(CO)=________L,V(![]() )=________L。
)=________L。
(2)若剩余气体的体积为a L,则原CO和![]() 的混合气体中V(CO):V(
的混合气体中V(CO):V(![]() )=________。
)=________。
(3)若剩余气体的体积为a L,则a的取值范围是___________。
解析:此题的知识载体是初中就熟悉的两个化学反应:①![]() ,②
,②![]() 。
。
三个设问由具体数字到抽象字母,思维难度逐渐加大。该题虽然有多种解法,但解题的突破口是对过量问题的讨论。
(1)根据反应特点可知![]() ,消耗
,消耗![]() ,剩余
,剩余![]() ,则
,则
![]()
由碳原子守恒,![]()
(2)由(1)的分析,将数字换成字母:
![]() ,即
,即![]()
则![]()
所以![]()
(3)由极值思想:设混合气体全部是![]() ,剩余气体是
,剩余气体是![]() ,则
,则 ![]()
设混合气体全部是CO,则 ![]()
故10<a<20。
四. 溶质不足量但溶剂可以继续反应,需慎重选量
Na等活泼金属可以与水直接反应,因此不能简单地按溶质的量进行计算。
例4:![]() 和Al各0.2 mol,分别放入1 L
和Al各0.2 mol,分别放入1 L ![]() 的三份稀盐酸中,产生
的三份稀盐酸中,产生![]() 的物质的量之比为()
的物质的量之比为()
A. 1:2:3 B. 3:2:1 C. 2:1:1 D. 1:1:1
解析:若不考虑过量,直接按金属计算则误选A项。根据![]() ;
;![]() ;
;![]() 可知盐酸对于三种金属都是不足量的,因此也会误选D项。事实上由于Na还可以与盐酸中的
可知盐酸对于三种金属都是不足量的,因此也会误选D项。事实上由于Na还可以与盐酸中的![]() 反应,不会剩余,最终产生0.1 mol
反应,不会剩余,最终产生0.1 mol ![]() ,是Mg和Al的2倍。选C项。
,是Mg和Al的2倍。选C项。
五、某种反应物剩余后可以发生副反应,需逆推讨论
两种反应物相互作用后,剩余物质可以继续发生其他反应,致使生成物的成分不确定,需逆向思维,分类讨论。例如![]() 与
与![]() 混合通入水中;
混合通入水中;![]() 与
与![]() 固体混合加热;
固体混合加热;![]() 与
与![]() 高温反应等。
高温反应等。
例5:将盛有100 mL ![]() 和
和![]() 混合气体的试管倒扣在水槽中,让其充分反应,结果剩余气体10mL,则原混合气体中
混合气体的试管倒扣在水槽中,让其充分反应,结果剩余气体10mL,则原混合气体中![]() 与
与![]() 的体积之比为()
的体积之比为()
A. 18:7 B. 3:2 C. 9:1 D. 43:7
解析:根据![]() 。
。
分类讨论:若剩余气体为![]() ,则
,则
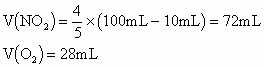
A项符合;
若剩余气体为NO,则原混合气体中![]() 过量,发生如下反应:
过量,发生如下反应:
![]()
所以![]()
则![]()
![]()
D项符合。
选A、D项。
六、生成物与过量的反应物继续反应,需确定比例守恒解题
两种物质发生反应后的一种生成物可以继续和过量的反应物作用,导致相对过量或不足。这类题有正向推导类型,如![]() 和
和![]() 按一定比例混合点燃,确定生成物量的多少;
按一定比例混合点燃,确定生成物量的多少;![]() 与
与![]() 的反应等。也有逆向推导类型,如将
的反应等。也有逆向推导类型,如将![]() (或
(或![]() 等)通入到
等)通入到![]() (或KOH)中,由生成固体物质的质量确定成分。基本思路是依据原子守恒(若为氧化还原反应可按电子守恒)巧妙解题。
(或KOH)中,由生成固体物质的质量确定成分。基本思路是依据原子守恒(若为氧化还原反应可按电子守恒)巧妙解题。
例6:向300 mL KOH溶液中缓慢通入一定量的![]() 气体,充分反应后在减压低温条件下蒸发所得溶液,得到了白色固体。问:
气体,充分反应后在减压低温条件下蒸发所得溶液,得到了白色固体。问:
(1)![]() 的通入量不同,得到的白色固体的组成也不同。试推断有几种可能的组成,并分别列出。
的通入量不同,得到的白色固体的组成也不同。试推断有几种可能的组成,并分别列出。
(2)通入2.24L(标准状况下)![]() 气体时,得到了11.9g白色固体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
气体时,得到了11.9g白色固体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
解析:(1)随着![]() 物质的量的增大,
物质的量的增大,![]() 与
与![]() 溶液依次发生如下反应:
溶液依次发生如下反应:
①![]()
②![]()
③当![]() 时,
时,![]() 。
。
减压低温条件下蒸发得到的混合物有多种可能。运用有序思维进行讨论:
I.如KOH剩余,白色固体为KOH和![]() ;
;
II. 恰好按①反应完全,白色固体为![]() ;
;
III. 开始发生反应②,白色固体为![]() 和
和![]() 的混合物;
的混合物;
IV. ![]() 全部转化为
全部转化为![]() 相当于发生了反应③。
相当于发生了反应③。
(2)![]()
若按①反应,得到固体的质量![]() ,不符合题意。
,不符合题意。
若按③反应,![]() ,不符合题意。
,不符合题意。
因此产物是![]() 和
和![]() 的混合物。
的混合物。
根据原子守恒、质量守恒,得:
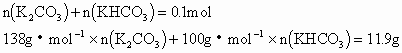
解得:![]()
![]()
则![]()
![]()
由K守恒,![]() 。
。
七、反应物互滴导致相对过量,需分析过程,讨论解题
某两种反应物可分步发生反应,当两者互滴时可使不足量的物质相对过量,本来停留在第一步的反应可进行完全。如盐酸与![]() 溶液;NaOH溶液与
溶液;NaOH溶液与![]() 溶液;
溶液;![]() 溶液与盐酸等。此类问题必须按实际反应进行过程分析,若按终态思维解题则导致失误。
溶液与盐酸等。此类问题必须按实际反应进行过程分析,若按终态思维解题则导致失误。
例7. 有两种实验操作:①向1L![]() 的
的![]() 溶液中逐滴加入200mL 6
溶液中逐滴加入200mL 6![]() 盐酸;②向200mL 6
盐酸;②向200mL 6![]() 的盐酸中逐滴加入1L 1
的盐酸中逐滴加入1L 1![]() 的
的![]() 溶液。在相同情况下产生气体的体积()
溶液。在相同情况下产生气体的体积()
A. 相同 B. 前者多 C. 后者多 D. 无法判断
解析:将盐酸缓慢滴入![]() 溶液时,先发生反应:
溶液时,先发生反应:![]() ,当
,当![]() 后,才继续第二步反应:
后,才继续第二步反应:![]() 。①中
。①中![]() ,
,![]()
,第一步HCl剩余0.2mol,第二步产生0.2mol CO2;②本来不足量的盐酸一直处于相对过量状态,按![]() 进行反应,盐酸全部反应消耗0.6mol
进行反应,盐酸全部反应消耗0.6mol ![]() ,产生0.6mol
,产生0.6mol ![]() 。故选C项。
。故选C项。
八、阴、阳离子反应顺序不同导致过量,需拆开离子区别对待
因氧化还原能力强弱的差别,使同一物质的阴、阳离子反应不同步,需讨论过量问题。如将![]() 通入
通入![]() 溶液,或将Zn、Fe、Cu混合物加入
溶液,或将Zn、Fe、Cu混合物加入![]() 溶液中。
溶液中。
例8. 标况下往500mL![]() 溶液中缓缓通入4.48L
溶液中缓缓通入4.48L ![]() ,测得溶液中有
,测得溶液中有![]() 的
的![]() 被氧化成
被氧化成![]() 单质,求原
单质,求原![]() 的物质的量浓度。
的物质的量浓度。
分析:氧化剂![]() 能将
能将![]() 氧化,但还原性顺序是
氧化,但还原性顺序是![]() ,因此根据
,因此根据![]() 的物质的量不同可有如下两种极端反应:
的物质的量不同可有如下两种极端反应:
①![]() ;②
;②![]() 。
。
解法一:根据方程式讨论过量问题,分步计算。设溶液中有x mol ![]() ,由反应①知消耗
,由反应①知消耗![]()
![]() ,生成
,生成![]() ;根据题意反应②知
;根据题意反应②知![]() 被氧化,消耗
被氧化,消耗![]() ,
,
则![]() ,
,
解得![]() ,
,
![]() 。
。
但该法麻烦,而以下解法2、解法3简捷易懂。其他解法不再赘述。
解法2:根据离子反应关系式解题(关系式法)。设溶液中有x mol ![]() 。
。
![]()
x ![]()
![]()
![]()
![]()
![]()
![]()
则
![]()
解得x=0.24mol,所以![]()
解法3:根据电子守恒法解题。
设溶液中有x mol ![]() ,
,
则
![]() ,
,
依得失电子守恒有:
![]()
![]()
九、给出反应物与生成物的比例关系,需对比分析,判断计算
例9. 在标准状况下,取甲、乙、丙各30.0mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化)。请回答:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________;乙组实验中盐酸__________。
(2)盐酸的物质的量浓度为__________。
(3)合金中Mg、Al的物质的量之比为__________。
(4)丙实验之后,向容器中加入一定量![]() NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各物质的物质的量浓度。
NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各物质的物质的量浓度。
解析:(1)盐酸的用量相同,甲、乙对比,甲中合金的质量增大气体体积增大,说明甲组中合金不足,盐酸过量。乙组中合金增重130mg,比甲组合金质量的一半略大,而气体体积增大56mL,远远小于甲组气体的一半,说明乙组盐酸不足。
(2)盐酸的浓度按乙组或丙组数据计算,由守恒关系:![]() ,得
,得![]() =0.030mol,
=0.030mol,![]() 。
。
(3)合金的物质的量按甲组计算,由![]() ,
,![]() ,则:
,则:
![]() ,
,
![]() 。
。
解得:![]()
![]() ,
,![]() 。
。
(4)由![]() ,
,![]() ,根据原子守恒,得
,根据原子守恒,得![]() ,
,![]() ,
,![]() 。
。
十、通过字母设置过量,需分类讨论计算
例10. 298K时,向V L真空容器内通入n mol SO2和m mol H2S。
(1)若n=2,则当m=____________时,反应后容器内气体的密度最小。
(2)若![]() ,则反应后氧化产物与还原产物的质量差为____________g。
,则反应后氧化产物与还原产物的质量差为____________g。
(3)若![]() 且反应后氧化产物与还原产物的质量和为48g,则n+m=____________。
且反应后氧化产物与还原产物的质量和为48g,则n+m=____________。
解析:(1)SO2与H2S发生归中反应:![]() =3
=3![]() (l),两者恰好完全反应时,气体体积为0,密度最小,n=2,则m=4。
(l),两者恰好完全反应时,气体体积为0,密度最小,n=2,则m=4。
(2)![]() ,则SO2过量,按
,则SO2过量,按![]() 计算,消耗SO2为
计算,消耗SO2为![]() ,生成氧化产物m mol,还原产物
,生成氧化产物m mol,还原产物![]() ,两者之差为
,两者之差为![]() ,质量为16m g。
,质量为16m g。
(3)5n=m,则SO2不足,![]() ,则
,则![]() ,
,![]() 。
。

- 全部评论(0)
