金属跟酸反应生成氢气专题
时间:2016-01-09 20:17 来源: 作者:张县 点击:次 所属专题: 金属与酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1)质量相等的不同种金属跟足量的酸反应
由于酸是足量的,无论是盐酸或稀硫酸,金属都能跟它们起反应放出氢气,放出氢气的量,由金属的相对原子质量及化合价来决定。例如,在初中化学中跟酸反应常见的金属有钠、镁、铝、锌、铁。经计算,上述五种金属与足量酸反应,产生1g氢气所需金属的质量分别为:

【例】质量相同的钠、镁、铝、锌分别与足量的酸反应产生的氢气量从大到小顺序是[ ]
A.Na>Mg>Al>Zn B.Zn>Al>Mg>Na C.Al>Zn>Na>Mg D.Al>Mg>Na>Zn
分析:从它们产生1g氢气所需金属分析Al为9g,Mg为12g,Na为23g,Zn为32.5g,如它们质量相同,如都为1g时,产生氢气的量就分别是9,12,23,32.5的倒数。
答:正确选项为D。
(2)过量的金属跟不足量的酸反应
它们的产生氢气的量由酸的量决定。如果是等量不同种酸,则酸的式量小的产生氢气大于式量大的酸。等量同种酸,产生氢气量相等。
【例】等量等溶质的质量分数的盐酸和硫酸,跟足量的锌反应,哪一种酸产生的氢气多?
答:盐酸产生的多。
【例】质量相等的镁、铝、锌、铁四种金属分别与足量的硫酸溶液反应,产生氢气的质量与四种金属质量的关系图像(见图),正确的是 [ ]
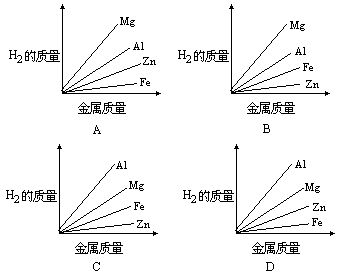
分析:四种金属与硫酸反应的化学方程式为:
Mg+H2SO4===MgSO4+H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
设参加反应的Mg、Al、Zn、Fe各为1g,根据规律可知:生成氢气的质量与金属的相对原子质量成反比,与该金属在生成物中的化合价

答:C
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
