教材分析(必修一):离子反应
时间:2023-08-08 14:37 来源:未知 作者:张德金 点击:次 所属专题: 离子反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、学会物质的构成方式

(1)有些物质是由离子构成的。(多数金属化合物和铵盐:特例AlCl3)
如NaCl,是由Na+和Cl-构成的。
NaOH,是由Na+和OH-构成的。
CaO,是由Ca2+和O2-构成的。
NH4Cl,是由NH4+和Cl-构成的。
(2)有些物质是由分子构成的。(多数非金属单质及化合物,稀有气体)
如氧气,由O2分子构成的。Cl2、N2、H2、Br2、I2等。
水,由H2O分子构成的。CO2、SO2、SO3、CO、CH4、HCl、H2SO4、HNO3、CH3COOH、H2CO3等。
稀有气体由分子构成,但它们的一个分子是由一个原子构成。如He、Ne、Ar等。
(3)有些物质是由原子构成的。(金属单质,个别非金属单质及化合物)
铜,由Cu原子构成的。
金刚石,石墨,都是由C原子构成的。
二氧化硅SiO2,由Si原子和O原子构成的。
2、学会从电解质的角度对物质进行分类

化合物分为两类,电解质和非电解质。
电解质包括多数金属氧化物、酸、碱、盐、水等。
从构成方式及电离方式又可以分为:
(1)只在熔融状态下电离的:由离子构成的金属氧化物。
在水溶液中或者与水反应生成碱,或者与水不反应也不溶解。
如CaO、CuO等。
(2)在熔融状态下和水溶液中都能电离的:由离子构成的部分碱和部分盐。
如NaOH、NaCl等。

(3)只在水溶液中电离的:由分子构成的酸。
如HCl、H2SO4、HNO3、CH3COOH、H2CO3等。
注意:
(1)有些盐和碱在高温下会分解,不存在熔融态。
如Fe(OH)3、NaHCO3、NH4Cl、CaCO3等。
(2)有些物质的水溶液中有离子,是因为物质与水发生化学反应生成新物质电离出来的。这些物质本身不能电离出离子。
如CO2、SO2、SO3等。
(3)在水中难溶的碱和盐,在水中也存在着微量的溶解和电离。
如Fe(OH)3、BaSO4、CaCO3等。
3、学会理解电离的过程
(1)NaCl的熔融电离:在热量的作用下,Na+和Cl-之间的一部分作用力被破坏,使Na+和Cl-由固定状态变成自由移动的状态。
CaO的熔融电离也是如此。
(2)NaCl在水溶液中的电离:在水分子的作用下,Na+和Cl-之间的作用力被破坏,使Na+和Cl-由固定状态变成自由移动的水合Na+和水合Cl-状态。

(3)HCl在水溶液中的电离:在水分子的作用下,H原子和Cl原子之间的作用力被破坏,使H和Cl由相互连结状态变成自由移动的水合H+和水合Cl-状态。
(4)注意:NaHSO4在熔融下:NaHSO4=Na++HSO4-。
在水溶液中:NaHSO4=Na++H++SO42-。
而NaHCO3在水溶液中:NaHCO3=Na++HCO3-。
4、学会化学方程式拆写为离子方程式的方法
“写-拆-删-查”
以Na2SO4溶液与BaCl2溶液反应为例:
(1)写:写出化学方程式
Na2SO4+BaCl2= BaSO4↓+2NaCl
(2)拆:(此处不仅会拆写离子,还要理解拆的原因是完全电离为自由移动的离子)
将易溶于水且易电离的物质(强酸、强碱、大多数可溶性盐)拆写成离子形式,其它的不能拆。
2Na++SO42-+Ba2++2Cl-= BaSO4↓+2Na++2Cl-
(3)删:(删的原因是反应前后的离子不变,就意味着没有参加反应)
SO42-+Ba2+= BaSO4↓
(4)查:检查离子方程式质量守恒和电荷守恒。
质量守恒:是指方程式两边的元素种类相同和原子数目相等。
电荷守恒:是指方程式两边所有粒子(包括原子、分子、离子、电子、质子等)带的电荷总数相同。异种电荷会相互抵消。
离子方程式:用实际参加反应的离子符号来表示反应的式子。
5、学会化学方程式转变为离子方程式
要知道常见的强酸、强碱、可溶性盐。注意:只能将溶于水的强酸、强碱、盐改写为离子,一些特殊离子的拆分要正确。例如:
(1)CH3COOH+NaOH=CH3COONa+H2O,改写后为CH3COOH+OH-=CH3COO-+H2O。
(2)Fe(OH)3+3HCl=FeCl3+3H2O,改写后为Fe(OH)3+3H+=Fe3++3H2O。
(3)NH3·H2O+HCl=NH4Cl+H2O,改写后为NH3·H2O+H+=NH4++H2O
(4)NaHCO3+NaOH=Na2CO3+H2O,改写后为HCO3-+OH-=CO32-+H2O。
(5)NaHSO4+NaOH=Na2SO4+H2O,改写后为H++OH-=H2O
(6)澄清石灰水通入CO2,Ca(OH)2+CO2=CaCO3↓+H2O,改写后为Ca2++2OH-+CO2=CaCO3↓+H2O
(7)石灰乳通入CO2,Ca(OH)2+CO2=CaCO3+H2O,改写后为Ca(OH)2+CO2=CaCO3+H2O(不能写成离子方程式,但它是离子反应)
6、学会离子之间发生反应的几种常见原因(离子能否共存问题)
溶液中的复分解反应的四个主要原因:中和反应或类似于中和反应生成水、强酸生成弱酸、强碱生成弱碱、易溶盐生成难溶盐。
(1)H+与OH-发生中和反应。
(2)H+与弱酸根发生强酸生成弱酸的反应。
如H+与CO32-,H+与CH3COO-等。
(3)OH-与弱碱阳离子发生强碱生成弱碱的反应。
如OH-与Fe3+,OH-与Cu2+等。
(4)难溶盐的阴离子和阳离子发生易溶盐生成难溶盐的反应。
如Cl-与Ag+,CO32-与Ca2+,SO42-与Ba2+等。
7、学会离子方程式的直接书写
(1)活泼金属与一些强酸反应生成氢气实质是金属与H+的反应。
如Zn与稀硫酸的反应:Zn+2H+=Zn2++H2↑。
(2)酸与碱的中和反应,实质是酸电离出的H+与碱电离出的OH-生成H2O的反应。
如NaOH溶液与稀硫酸的反应:OH-+H+= H2O。
(3)生成难溶盐的反应,实质是难溶盐的两种离子相互结合生成沉淀造成的。
如CaCl2溶液与Na2CO3溶液的反应:Ca2++ CO32-= CaCO3↓。

(4)生成弱酸的反应,实质是强酸的H+与弱酸盐中的弱酸根能生成弱酸造成的。
如盐酸与Na2CO3溶液的反应:2H++ CO32-=H2O +CO2↑。

(5)生成弱碱的反应,实质是强碱的OH-与弱碱盐中的弱碱阳离子能生成弱碱造成的。
如NaOH溶液与FeCl3溶液的反应:3OH-+Fe3+=Fe(OH)3↓。
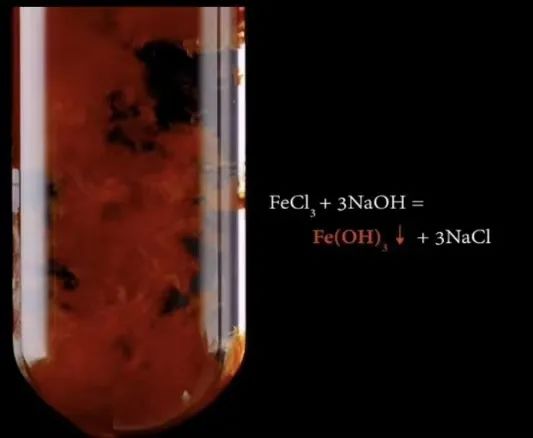
8、学会离子方程式书写的注意事项
(1)反应原理要正确。
如Fe与H+反应不能生成Fe3+:2Fe+6H+=2Fe3++3H2↑是错误的,不能生成Fe3+。
(2)拆分要正确。
如CaCO3与稀盐酸的反应:CO32-+2H+=CO2↑+H2O是错误的,CaCO3不能写成CO32-。
(3)质量要守恒。
CO32-+H+=CO2↑+H2O是错误的,H不守恒。
(4)电荷要守恒。(离子反应具有的规律)
Cu+Ag+=Cu2++Ag是错误的,离子方程式两边所带的电荷总数不相等。
(5)不能漏掉离子反应。
如Ba(OH)2溶液与CuSO4溶液反应:
Ba2++SO42-=BaSO4↓是错误的,溶液中的H+和OH-也发生离子反应。
(6)阴离子和阳离子的个数要符合电离出来的比例。
如Ba(OH)2溶液与H2SO4溶液反应:
Ba2++OH-+H++SO42-=BaSO4↓+H2O是错误的,Ba2+与OH-的数目比应该是1:2。
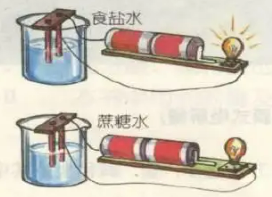
9、学会溶液的导电能力的影响因素(同时学会金属导电的原因)
溶液导电与溶液中有自由移动的阴离子和阳离子有关。
溶液的导电能力受离子的浓度、离子带的电荷数的影响。
离子的浓度越高,导电能力越强。离子带的电荷数越多,导电能力越强。(不用引入物质的量浓度概念)
金属导电的原因是金属中有自由电子,导电是因为自由电子的定向移动。
10、可以加入对电解质进行强电解质和弱电解质的分类。
不用进行弱电解质电离的可逆过程的讲授和分析,只介绍溶于水的强电解质在水溶液中完全电离,溶于水的弱电解质在水溶液中只发生很少量电离即可。

11、先不用学会过量问题,等学到Na2CO3、NaHCO3时再学过量问题。

- 全部评论(0)
