晨读笔记:原子结构与元素周期表
时间:2023-08-09 16:34 来源:未知 作者:化学自习室 点击:次 所属专题: 原子结构 元素周期表
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、原子结构
01.原子结构的发现史:
1803年 道尔顿模型 原子是一个坚硬的小球
1897年 汤姆生模型 原子是一个带正电荷的球,电子镶嵌在里面,好似一块葡萄干面包
1911年 卢瑟福模型 原子的大部分体积是空的,电子围绕着一个带正电荷的很小的原子核运转。
1913年 玻尔模型 电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一层面跃迁到另一个层面时,原子便吸收或释放能量。
20世纪20年代以来 现代模型(电子云模型)电子绕核运动形成一个带负电荷的云团,在一个确定的时刻不能精确测定电子的确切位置
02.原子由原子核和核外电子构成,其中原子核带正电,电子带负电。
03.原子核由中子和质子构成,但质子数与中子数的关系是可大可小可等。
如:1H中,质子数大于中子数;2H中,质子数等于中子数;3H中,质子数小于中子数。
04.原子的质量主要集中在原子核上,可以通过α粒子散射实验(又称金箔实验),实验用α射线轰击厚度为微米的金箔,实验结果表明,绝大多数α粒子穿过金箔后仍沿原来的方向前进,但有少数α粒子发生了较大的偏转,并有极少数α粒子的偏转超过90°,有的甚至几乎达到180°而被反弹回来,这就是α粒子的散射现象。由实验可知,正电荷集中在原子中心;大多数α粒子穿透金箔表明原子内有较大空间,而且电子质量很小;一小部分α粒子改变路径表明原子内部有一微粒,而且该微粒的体积很小,且带正电;极少数的α粒子反弹表明原子中的微粒体积较小,但质量相对较大。卢瑟福从1909年起做了著名的α粒子散射实验,实验的目的是想证实汤姆孙原子模型的正确性,实验结果却成了否定汤姆孙原子模型的有力证据。在此基础上,卢瑟福提出了原子核式结构模型。
05.质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加所得的数值即为质量数,用符号A表示。
06.质量数(A)=质子数(Z)+中子数(N)
07.质子数=核电荷数=中性原子的核外电子数
08.阳离子:质子数=核外电子数+电荷数
09.阴离子:质子数=核外电子数-电荷数
10.

 中,Z-质子数,A-质量数,n-原子个数,m-离子所带电荷,x-化合价。
中,Z-质子数,A-质量数,n-原子个数,m-离子所带电荷,x-化合价。
11.有质子的微粒不一定有中子,如:1H;有质子的微粒不一定有电子,如:H+
12.质子数相同的微粒不一定属于同一种元素,如:F与OH-
13.核外电子数相同的微粒,其质子数不一定相同,如:Al3+和Na+、F-等,NH 与OH-等
与OH-等
14.在多电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动;能量高的,通常在离核远的区域运动。核外电子的分层运动,又叫核外电子的分层排布。
15.电子离核越近,能量越低,离核越过,能量越高。
16.核外电子优先排布在能量较低的电子层上,然后排布在能量较高的电子层上
17.第1234567电子层,可以用K、L、M、N、O、P、Q表示。
18.每个电子层最多容纳2n2个电子,最外层电子数≤8(仅有K层≤2),次外层≤18,倒数第3层≤32。
19.对于主族元素,除最外层外,每一层的电子数必须为2N2这个数值
20.核外电子排布的几条规律是相互联系的,不能孤立地理解,必须同时满足各项要求。
21.原子形成离子时,核外电子数变化,核内质子数不变。
22.最外层电子较少的(<4),一般易失去电子达到稳定结构,表现出金属性;
23.最外层电子较多的(>4),一般易得电子,表现出非金属性。
24.元素(Chemical Element)就是具有相同的核电荷数(质子数)的一类原子的总称。
25.核素具有一定数目质子和一定数目中子的一种原子。
26.一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
27.不同的核素可能具有相同的质子数,如1H、2H,
不同的核素可能具有相同的中子数,如14C、16O等,
不同的核素可能具有相同的质量数,如14C与14N。
28.如果不同的核素具有相同的质子数和不同的中子数,它们之间就互称同位素。
29.同位素是在同期表中同一位置的元素,只有质子数相同,才会在周期表中同一位置。
30.由于同位素最外层电子数相同,故化学性质几乎完全相同,而物理性质有一定差异。
31.天然存在的同位素,各种同位素之间保持一定的比例关系,且相对稳定。
32.在某种天然元素里,不论是游离态还是化合态,各种同位素的丰度(原子百分比)一般为定值。
33. C在考古工作中用于测定文物的年代(根据
C在考古工作中用于测定文物的年代(根据 C遗留数量及其半衰期推断生物体的存在年代)。
C遗留数量及其半衰期推断生物体的存在年代)。
34. U用于制造原子弹、核发电。
U用于制造原子弹、核发电。
35. H、
H、 H用于制造氢弹。
H用于制造氢弹。
36.放射性同位素释放的射线用于育种、治疗肿瘤等。
37.以18O为例说明示踪原子可以判断某些有机反应的断键位置。
38.原子的相对原子质量:该原子的真实质量与12C的1/12的比值。
39.原子的近似相对原子质量:该原子的相对原子质量的近似值,在数值上等于质量数。
40.元素的相对原子质量:元素的各种同位素的相对原子质量乘以丰度,然后求和。
41.元素的近似相对原子质量:元素的各同位素的近似相对原子质量(质量数)乘以丰度,再求和。
42.某粒子为35Cl,我们仅仅能知道其质量数为35,其近似相对原子质量为35,该氯原子的相对原子质量,氯元素的相对原子质量、氯元素的近似相对原子质量都无法获知。
43.根据信息,熟练推导相关元素:
①最外层电子数为1的元素有:H、Li、Na
②最外层电子数为2的元素有:He、Be、Mg
③最外层电子数与次外层电子数相等的元素有:Be、Ar
④最外层电子数是次外层电子数2倍的元素是:C
⑤最外层电子数是次外层电子数3倍的元素是:O
⑥次外层电子数是最外层电子数2倍的元素有:Li、Si
⑦内层电子总数是最外层电子数2倍的元素有:Li、P
⑧电子层数与最外层电子数相等的元素有:H、Be、Al
⑨最外层电子数是电子层数2倍的元素有:He、C、S
⑩最外层电子数是电子层数3倍的元素有:O
44.10e-的粒子有
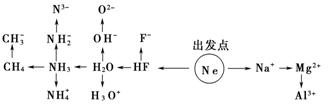
①Ne,
②Na+、Mg2+、Al3+(简单阳离子)
③HF、H2O、NH3、CH4(氢化物)
④F-、OH-、NH2-(以③为主线:失去一个H+)
⑤O2-、 N3-(以③为主线:失去2个或3个H+)
⑥H3O+ NH4+(以③为主线:得到一个H+)
45.18e-的粒子有
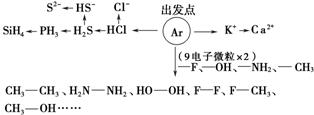
①Ar,
②S2-、Cl-、P3-、HS-、O22-,
③K+、Ca2+,
④H2S、PH3、HCl、H2O2、N2H4、F2、CH3CH3、CH3F、CH3OH、SiH4等。
二、元素周期表
01.1869年,俄国化学家门捷列夫首先编制了第一份元素周期表。
02.门捷列夫编制的元素周期表,是按元素相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵列,与现行的原则并不相同,现行排列原则是按核电荷数由小到大排列。
03.随着科学的发展,元素周期表中为未知元素留下的空位先后被填满,现在已发现了118种元素。
04.按照元素在周期表中的顺序给元素编的序号称为原子序数
05.原子序数=核电荷数=质子数=原子核外电子数
06.横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列
07.纵列原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列
08.每一横行,称为一个周期,一共7个周期,123为短周期,4567为长同期。
09.每一纵行,称为一族,族有三种:主族、副族、0族。
10.主族有7个,分别用IA、IIA、IIA、IVA、VA、VIA、VIA表示。
11.副族有8个,分别用IB、IIB、IIB、IVB、VB、VIB、VIB、VII表示。
12.VII族是副族,但是没有标B,VII族有三个纵行(为8、9、10三个纵行)。
13.元素周期表的结构为:七行十八列、七周期十六族
14.周期表也可以通排成18列,可以记忆为,12345678,12345670,8里有3列,标上AB即可。
15.第一周期有2种元素、第二周期有8种元素、第三周期有8种元素、第四周期有18种元素、
第五周期有18种元素、第六周期有32种元素、第七周期有32种元素
16.第三、四周期相差10种元素,第四周期开始有副族元素,而副族占据10列,故多出10种元素。
17.第五、六周期相差14种元素,是由于镧系一个格格里挤下了15种元素,故多出了14种。
18.过渡元素:元素周期表中从第ⅢB族到第ⅡB族共10个纵列,均为过渡元素,这些元素都是金属元素,又被称为过渡金属元素。
19.核外电子层数=周期数
20.主族序数=最外层电子数=最高正价=8-|最低负价|
21.原子序数是奇数的主族元素,其所在主族序数必为奇数
22.原子序数是偶数的主族元素,其所在主族序数必为偶数
23.0族元素的周期序数和原子序数
| 0族元素 | He | Ne | Ar | Kr | Xe | Rn |
周期序数 | 一 | 二 | 三 | 四 | 五 | 六 |
原子序数 | 2 | 10 | 18 | 36 | 54 | 86 |

- 全部评论(0)
