教材分析(物质结构与性质):配合物与超分子
时间:2023-09-04 16:44 来源:未知 作者:张德金 点击:次 所属专题: 超分子 配合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、配合物
1、CuSO4固体是白色的,CuCl2固体是棕黄色的,CuBr2固体是深褐色的。

它们的稀的水溶液为什么都是蓝色的?

溶液呈蓝色的原因是,溶液中存在四水合铜离子,可表示为[Cu(H2O)4]2+。
在四水合铜离子中,水分子与铜离子之间的作用力是什么呢?
2、配位键
(1)在四水合铜离子中,水分子提供孤电子对,铜离子提供空轨道,形成共用电子对,这样的“电子对给予-接受”键被称为配位键。
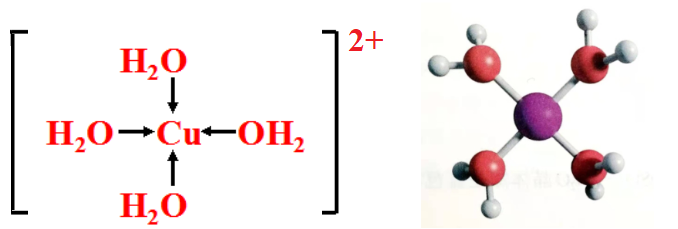
[Cu(H2O)4]2+结构
五水合硫酸铜晶体显蓝色的原因是晶体中存在[Cu(H2O)4]2+。
(2)在硫酸铜溶液中加氨水,不但能得到蓝色沉淀Cu(OH)2,还得到绛蓝色溶液。绛蓝色溶液中含有四氨合铜离子[Cu(NH3)4]2+。

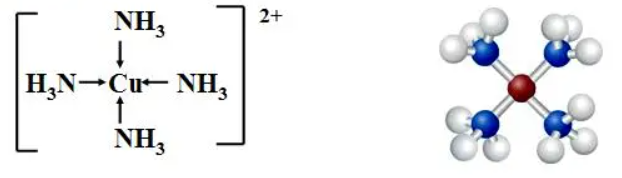
Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3=[Cu(NH3)4] (OH)2
这说明氨分子与铜离子形成配位键的能力比水分子的能力强。
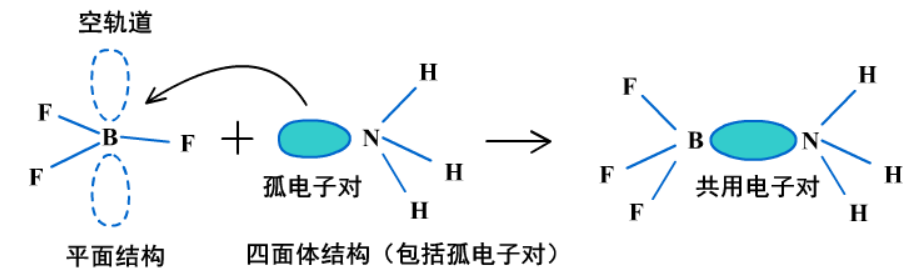
(3)BF3与NH3形成配位键的过程。
BF3+NH3=BF3←NH3
BF3中B的周围只有三对共用电子对,没有孤电子对,有一个空的2p轨道,属于缺电子原子。NH3中N的周围有三对共用电子对和一对孤电子对。
(5)实验
NaCl溶液中滴入几滴AgNO3溶液,再滴入氨水,观察现象。
先生成白色沉淀,滴入氨水后,白色沉淀消失。
NaCl+AgNO3=AgCl↓+NaNO3
AgCl +2NH3= [Ag(NH3)2]Cl
3、配合物
把金属的离子或原子与某些分子或离子以配位键结合形成的化合物称为配位化合物,简称为配合物。
多数指由过渡金属的原子或离子(价电子层的部分D轨道和S、P轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如Cl-、CN-等)通过配位键结合形成的化合物。
如[Cu(NH3)4] SO4、[Ag(NH3)2]Cl、Fe(SCN)3、K3[Fe(CN)6]、H2[CuCl4]、Ni(CO)4等。
配位键的强度有大有小,配合物有的很稳定,有的很不稳定。过渡金属的配合物比主族金属的配合物要多。
二、超分子
1、超分子
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
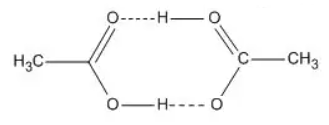
乙酸二聚体
分子聚集体有的是有限的,有的是无限伸展的。超分子中分子的定义是广义的,也包括聚合体离子。

超分子比较复杂,但有一定的组织和完整性,具有明确的微观结构和宏观特性。
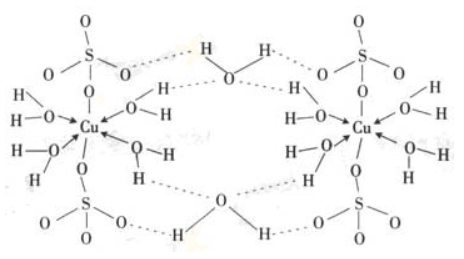
超分子中的分子间相互作用包括:金属离子的配位键、氢键、π-π堆积作用、静电作用、疏水作用、范德华力以及重叠作用等。它们的强度分布由π-π堆积作用及氢键的弱到中等,到金属离子配位键的强或非常强。

2、超分子的两个重要特征
(1)分子识别
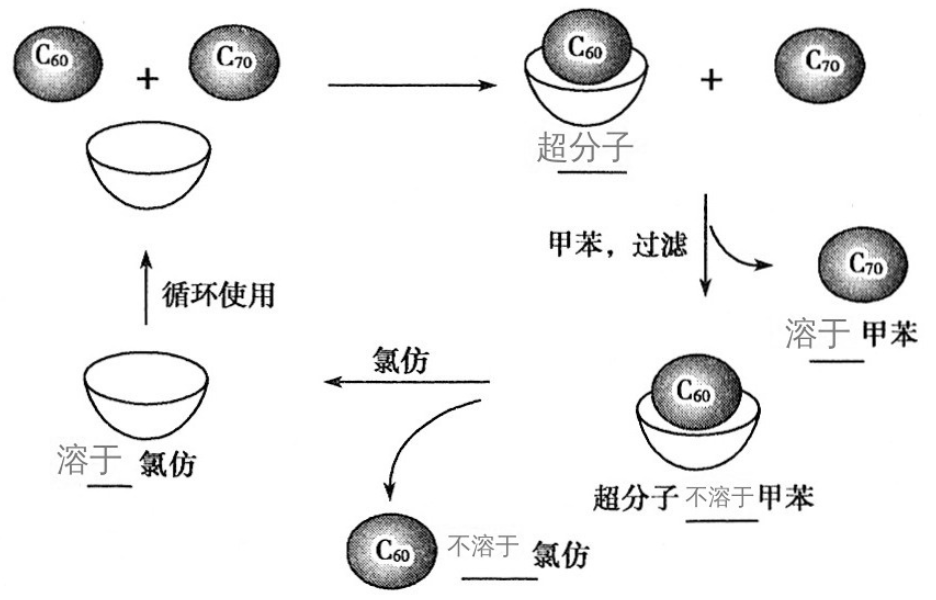
①分离C60和C70实验
将C60和C70的混合物加入一种空腔大小适配C60的“杯酚”(超分子)中,C60就会装入“杯酚”中。
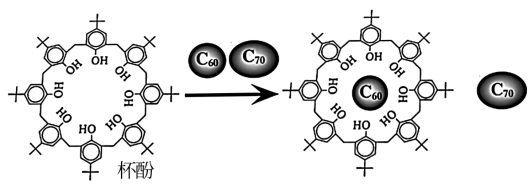
再加入甲苯溶剂,将未装入“杯酚”的C70溶解,过滤并分离得到C70。
再向不溶物中加入氯仿,氯仿溶解“杯酚”,不溶的C60得到释放并沉淀,过滤分离。
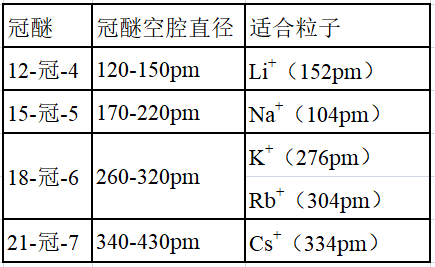
②冠醚识别碱金属离子
冠醚是皇冠状分子,不同大小的空穴适配不同大小的碱金属离子。利用不同的冠醚,就能分离不同的碱金属离子。
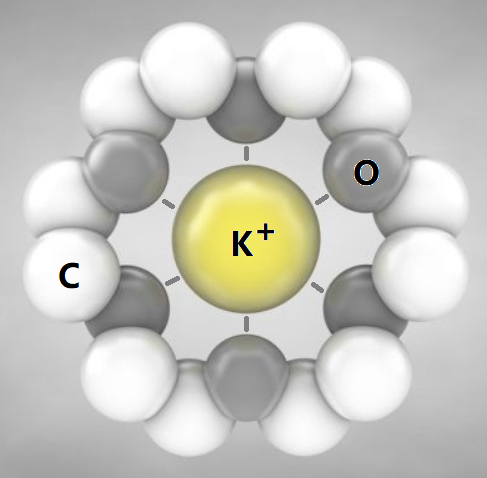
(2)自组装
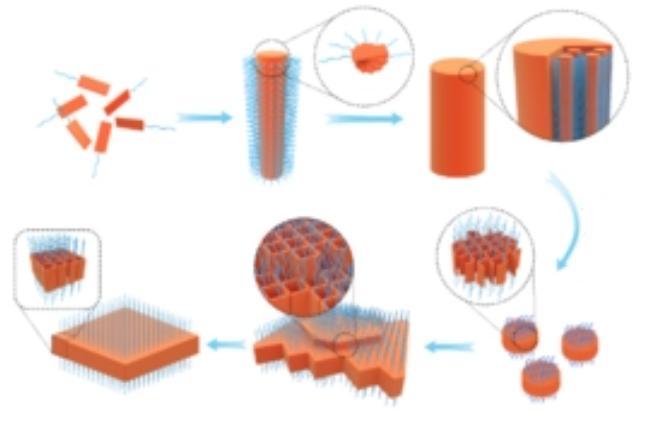
自组装是指基本结构单元(分子、纳米材料、微米或更大尺度的物质)自发形成有序结构的一种技术。在自组装的过程中,基本结构单元在基于非共价键的相互作用下自发地组织或聚集为一个稳定、具有一定规则几何外观的结构。

- 全部评论(0)
