离域(共轭)大π键知识点精析
时间:2024-04-08 08:11 来源:未知 作者:化学自习室 点击:次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
σ键:原子轨道沿着轨道对称轴的方向“头碰头”重叠形成的共价键。
π键:由两个成键原子的P 轨道通过“肩并肩”的方式重叠形成。
2.定域π键与离域π键
定域π键:普通π键(定域π键)就是P轨道肩并肩重叠形成的,限于2个原子。
离域π键:由三个或三个以上的原子形成的π键。这种多个原子上相互平行的P轨道,它们连贯地 “肩平肩”地重叠在一起而形成离域的化学键键,称其为大π键。 这种在化合物分子或离子中的π键电子不仅仅局限于两个原子的之间,而是在参加成键的多个原子形成的分子或离子骨架中运动。
3.离域π键形成条件
(1)所有参与形成离域π键的原子必须在同一直线或同一平面上。所以中心原子只能采取sp2 或sp杂化。
(2)参与离域π 键的原子都必须提供一个或两个互相平行的P 轨道。
(3) 形成离域π 键的P电子的总数小于P 轨道数的两倍。
4.离域π键表示方法

n 指参与形成大π 键的原子数,m 为共用电子个数,m ≦2n
 如
如 指参与形成大π 键的原子数有3 个(一般粒子有几个原子,就是几个p 轨道),平行p 轨道里的电子数为4。
指参与形成大π 键的原子数有3 个(一般粒子有几个原子,就是几个p 轨道),平行p 轨道里的电子数为4。
5.m 值的计算:ABn型分子或离子
提醒:中心原子若有孤对电子,一定要把孤对电子从价电子总数中减去。
6.常见分子或离子的大π键
(1)ABn型分子
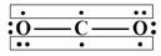
①CO2:
分析:(1)CO2中C 原子为sp杂化,两端的O 原子可视为不杂化。
(2)C原子sp 杂化轨道为两个能量相等的Px 轨道,其中各含有1 个成单电子;Py 轴上有1 个成单电子;Pz 轴上也有1 个成单电子。
(3)O原子2s2、2P 轨道中其中一个轨道上面均为两个自旋相反的电子。另两个P 轨道上的成单电子分别与 C 原子的 sp杂化轨道形成σ键和π键。
(4)第一套:y 轴从左至右的电子数为:1、1、2,共 4e-;第二套:z 轴从左至右的电子数为:2、1、1,共 4e-;均为三个 P 轨道,故 CO2中存在两套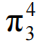 的大π键。
的大π键。


另计算如下:(中心原子C 不存在孤对电子)
(1)CO2中的价电子总数为 4+6×2=16。
(2)C 与 O 形成σ键的电子数为 2×2=4。(C和 O各拿出1个电子,共 2组)
(3)孤对电子:O 原子中:2S、2P中有一个轨道中存在一对孤对电子(共 4 个),2 个 O原子共有:4×2=8。
(4)形成大π 键的电子,即为剩余电子,共有:16-4-8=4。
(5)O、C、O 原子的每个原子的某一 P 轨道中共有 4 个电子可以共享,即大π 键为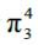 。
。
等电子体:原子总数相同、价电子总数相同的分子(微粒)。互为等电子体的微粒特点:空间构型相同
CO2的等电子体:

②O3:O3 可以看成O·O2。
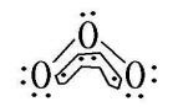
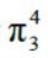

中心原子sp2杂化,所以中心原子中有1 对孤对电子没有参与形成大π 键
m 值计算:m= 6×3-2×2-2-4×2=4
O3的等电子体:

③CO32-:

中心原子sp2杂化,中心原子的所有电子都参与成键m值计算:m= 4+6×3+2-2×3-4×3 = 6

(2)环状分子
环上的原子都是sp2杂化

NO2 分子中离域π键的讨论
关于NO2分子的离域π 键,可能有两种(图3)。

中心原子N 采用sp2杂化,分子共平面,但其周围只有2 个O原子,故其中2 个杂化轨道与O原子的P 轨道重叠形成σ 键。但是,还剩下的1 个杂化轨道里是填充1 个电子还是1 对电子呢(图4)?如果填充1 对电子,则未参与杂化的Pz 轨道上剩下1 个电子,与2 个配位O原子中的Pz 轨道重叠,形成τ 离域π 键(图3(a))。反之,形成
离域π 键(图3(a))。反之,形成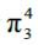 离域π 键(图3(b))。
离域π 键(图3(b))。
与CO2分子中离域π 键的讨论一样,在这种情况下,我们应该结合物质本身的性质来判断。我们知道,NO2分子容易二聚形成无色的、反磁性的N2O4分子,而这一过程,可以看作是2 个NO2分子中的成单电子配对形成σ 键所致(图5),这也说明在其分子中,杂化轨道上尚有1 个成单电子,而未参与杂化的Pz轨道上填充的是1 对电子,故在NO2分子中形成的是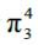 离域π 键(图3(b))。
离域π 键(图3(b))。



- 全部评论(0)
