“硫及其化合物性质”的两条主线
时间:2016-01-21 12:21 来源: 作者:吴传鹏 点击:次 所属专题: 硫及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
含硫物质多种多样,它们在一定的条件下可以相互转化。通过氧化还原反应可以实现含不同价态硫元素的物质之间的转化;通过非氧化还原反应可以实现含有相同价态硫元素的不同物质之间的转化。为了更好地掌握硫及其化合物的性质,学习中应抓住两条主线。
一、以氧化还原反应规律为学习的主线
硫和硫的化合物及不同价态的含硫物质是通过氧化还原反应规律联系在一起的。回顾氧化还原反应的基本规律,在理解规律的基础上记忆和书写有关反应的化学方程式,可以达到事半功倍的效果。
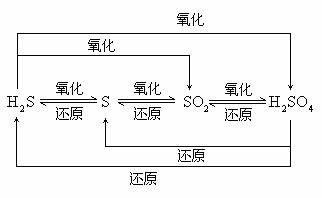
1. 性质规律
处于最高价态的元素只有氧化性,处于最低价态的元素只有还原性,处于中间价态的元素既有氧化性,又有还原性。如果只从S元素考虑,![]() 只有还原性,
只有还原性,![]() 只有氧化性,
只有氧化性,![]() 既有氧化性,又有还原性。这些中间价态的硫元素遇到强还原剂时,表现氧化性;遇到强氧化剂时,表现还原性。如S与
既有氧化性,又有还原性。这些中间价态的硫元素遇到强还原剂时,表现氧化性;遇到强氧化剂时,表现还原性。如S与![]() 反应时生成
反应时生成![]() ,与
,与![]() 反应时生成
反应时生成![]() 。
。
2. 价态归中规律
当高价态硫与低价态硫之间发生氧化还原反应时,一般遵循价态归中规律。如:
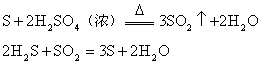
3. 歧化规律
在一定的条件下,处于中间价态的硫能发生歧化反应。如:
![]()
4. 邻位转化规律
在氧化还原反应中,某一价态的硫一般首先转化到相邻的价态。如S燃烧时总是生成![]() 催化氧化时再生成
催化氧化时再生成![]() 。
。
在![]() 的转化中,若用氧化剂氧化
的转化中,若用氧化剂氧化![]() 价硫首先被氧化为单质硫,再被氧化为+4价的
价硫首先被氧化为单质硫,再被氧化为+4价的![]() ,直到最后被氧化为
,直到最后被氧化为![]() 价的
价的![]() 。
。
如果浓硫酸被还原剂所还原,则+6价硫首先被还原为+4价的![]() ,再被还原为单质硫,直到最后被还原为-2价的
,再被还原为单质硫,直到最后被还原为-2价的![]() 。
。
5. 跳位转化规律
当低价态的硫遇到足量的强氧化剂时,可发生跳位转化。如:
![]()
![]()
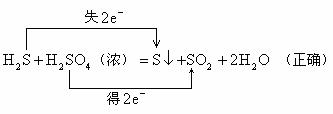
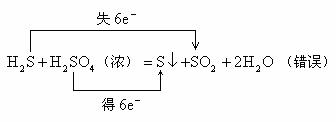
6. 不交叉规律
在氧化还原反应中,以硫元素相邻价态之间的转化最容易;相邻价态的硫元素之间不发生氧化还原反应;硫元素的不同价态之间发生反应时,硫元素的化合价只靠近而不交叉。如:
相同价态的不同含硫化合物间是通过酸碱反应规律联系在一起的。酸碱反应大部分都是酸、碱、盐和氧化物之间的复分解反应。回顾这些基本而重要的反应规律,既能加深对离子反应的条件、本质等知识的理解,又能触类旁通,掌握其他不同类别物质间的转化反应,减轻记忆负担。
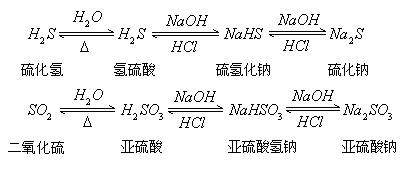
1. 酸与碱发生中和反应生成盐和水
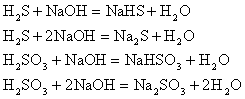
![]()
2. 酸与盐反应生成新酸和新盐
相对强的酸可以制备相对弱的酸。如:
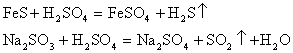
3. 盐与碱反应生成新盐和新碱
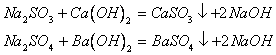
4. 酸性氧化物与碱反应生成盐和水
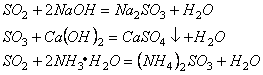
5. 酸性氧化物与水化合成相应的酸
![]()
6. 酸(或酸性氧化物)与正盐反应生成酸式盐
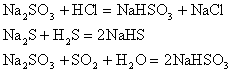
7. 酸式盐与碱反应生成正盐和水

![]()

- 全部评论(0)
