卤素的数字结构
时间:2016-01-17 11:32 来源: 作者:关平 点击:次 所属专题: 卤族
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、1个原则
二、碘的两大特性
三、三种气体的制法
四、四组物质比较
五、卤素单质的5大规律
六、氯元素6种常见的化合价及其对应的物质:
七、卤化氢的7大共性
八、氯水的8大主要性质或用途
九、9个问题
十、测评与参考答案
相似相溶原则:结构相似相近者易相溶也;如极性物质易溶于极性溶剂,非极性物质易溶于非极性溶剂;或可以认为低级醇、酚等物质易溶于水,而酯、醚、卤代烃等难溶于水。
二、碘的两大特性
1、碘的升华:在受热条件下固体不经液体状态而直接变为气态的过程叫升华,而气体直接变为固体的过程叫凝华;除碘能升华外,萘、蒽、干冰(从理论上说,通常情况下呈气态的晶体,均能升华),其实碘不但能升华,它还能凝华,另外硫也能凝华。
2、碘遇淀粉溶液变蓝,其实质是形成了一种包合物,碘与淀粉之间主要是由分子间作用力结合在一起的;根据这一特性可以用来进行鉴定,也可以作为滴定时的指示剂(如用碘对某还原性物质进行滴定时,可以选用淀粉作为指示剂,一旦还原剂消耗完毕,则溶液就呈现出显明的蓝色)。
三、3种气体的制法
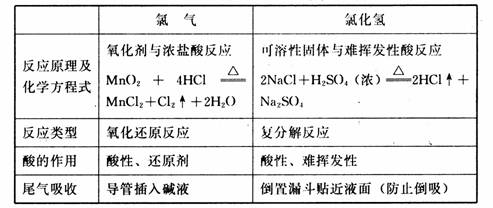
1、氯气:用浓盐酸和二氧化锰在加热条件下进行反应制得,若用高锰酸钾则不用加热;从理论上说,只要该物质的氧化性强于氯气,则均可以用来制备氯气。如二氧化铅、次氯酸钙、次氯酸钠等均可以。反应的化学方程式和离子方程式如下:
MnO2 + 4HCl == MnCl2 + Cl2↑ + 2H2O MnO2 + 4H+ + 2Cl— == Mn2++ Cl2↑+ 2H2O
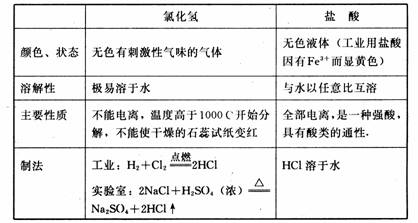
2、氟化氢:用浓硫酸与氟化物在加热条件下进行反应,要注意不能用玻璃器皿,因为氟化氢要腐蚀玻璃,据此可以用HF气体来雕刻玻璃。2NaF + H2SO4 == Na2SO4 + 2HF↑
3、氯化氢(溴化氢、碘化氢):用浓硫酸(浓磷酸)与氯化钠在加热条件下进行反应。
NaCl + H2SO4 == NaHSO4 + HCl↑ NaHSO4 + NaCl(加强热) == Na2SO4 + HCl↑
①制氯气与氯化氢气体可以用相同的发生装置;
②二者的不同点在于尾气吸收时,氯化氢需要接一个倒置的小漏斗,以免倒吸。
四、4组物质比较
1、第一组:液氯与氯气
氯气 | 液氯 | |
组成 | 氯元素 | 氯元素 |
物质类别 | 单质 | 单质 |
状态 | 气态 | 液态 |
颜色 | 黄绿色 | 墨绿色 |
保存 | 常温、一定压力 | 低温、高压 |
化学性质 | 二者相同 | 二者相同 |
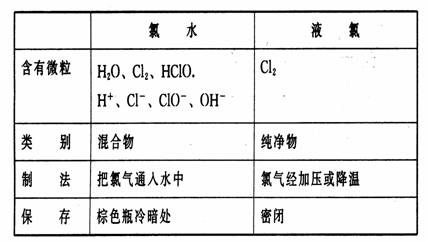
2、液氯与氯水
氯水 | 液氯 | |
含有微粒 | ||
3、氯气与氯化氢
4、氯化氢与盐酸
五、卤素单质的5大规律(F2——→I2)
1、 颜色:淡黄绿色、黄绿色、棕红色、紫黑色,逐渐加深;
2、 状态:气态、气态、液态、固态,从气态到固态,一应俱全;
3、 毒性:剧毒、毒、毒、较低毒性,逐渐减弱;
4、 原子半径:随着核电荷数的增加,核外电子层数增多,原子半径增大;
5、 化学活泼性:最强的非金属单质(自然界中)、强、较强、中等强度,单质的化学活泼性逐渐减弱。
六、6种常见的化合价及其对应的物质(以氯元素为例,溴、碘可以仿照,但氟元素不能仿照,希引起注意):
1、+7价:高氯酸(HClO4)、高氯酸钾、高氯酸铵等;
2、+5价:氯酸(HClO3)、氯酸钾;
3、+3价:亚氯酸(HClO2);
4、+1价:次氯酸(HClO)、次氯酸钠、次氯酸钙;
5、0价:氯气、液氯;二者均为单质,具有相同的化学性质,所不同的是微粒间的距离;
6、—1价:盐酸、金属氯化物、三氯化磷(通常情况下为无色液体)、五氯化磷(通常情况下为白色固体,与三氯化磷一样均为制农药时的中间产物,且二者均能在一定条件下发生水解反应,生成相应的含氧酸和盐酸)等;需要说明的是:氟元素只有负价,没有正价,当氟气与水反应时生成的是氢氟酸和氧气,而没有次氟酸生成,所以说氟气是自然界中最强的氧化剂;而且氟化物也与众不同,如卤化银中氟化银可溶、卤化钙中氟化钙难溶等等。
七、卤化氢的7大共性
1、 均为无色气体;
2、 均有刺激性气味(氟化氢气体有剧毒);
3、 均极易溶于水,能形成喷泉;
4、 水溶液均极易挥发,在液面上方形成白雾;
5、 水溶液均为强酸(除氢氟酸),且叫氢某酸;
6、 均可用高沸点酸与卤化物在加热条件下制得;
7、 均可由卤素单质与氢气反应而得到。
八、氯水的8大主要性质或用途
1、由于氯分子的存在,因此:
(1)氯水有毒,自来水中有少量氯气,故养不活金鱼。
(2)新制氯水可以代替氯气;如在碘化钾溶液中滴入氯水。
2、由于H+的存在,因此新制氯水呈酸性,其中大部分氢离子来自盐酸中,因盐酸是强酸,次氯酸是弱酸。
3、由于Cl-的存在,因此用自来水配制硝酸银溶液,往往呈现浑浊。
4、由于次氯酸的存在,因此:
(1)干燥的Cl2无漂白性,而氯水却有,所以氯水能使指示剂变色,也可以使其褪色。
(2)新制氯水应避光保存,否则要分解而导致失效。
(3)与碱作用可以制成漂白粉,便于保存,而使用时加酸有利于增强漂白效果。
(4)氯水可以用于消毒、杀菌。
5、由于氯气与水反应生成盐酸和次氯酸,存在着平衡,故:
(1)氯气可溶解于水,不能用排水法收集,实际上与水反应的氯气约占1/3。
(2)收集Cl2可用排饱和食盐水的方法,由于大量Cl—的存在而抑制了Cl2的溶解。
(3)在实验室中可用碱来吸收多余的氯气,是因为OH-的存在,减少了生成物的浓度使平衡向正反应方向移动,从而促进了Cl2的溶解。
6、新制氯水与久制氯水在成分、性质和颜色上均有所不同,是因为次氯酸的分解,使平衡向正反应方向移动,导致氯气全部与水反应。
7、在氯水中加入NaHCO3后,可使HC1O的浓度增大,因平衡会向右移动,加入NaOH后,平衡也向右移动,但HClO浓度会减少,因为HCl、HClO均与NaOH反应,而HClO与NaHCO3不反应。
8、氯水能导电,但它既不是电解质,也不是非电解质;而要使氯气能发生喷泉现象,只要用浓碱液作为吸收液即可。
九、9个问题
1、卤素性质相似及差异的原因何在?
2、新制氯水与久置氯水在颜色、成分及性质上有何不同?举例说明。
3、如何检验卤素离子?写出反应的离子方程式。
4、强氧化剂能够漂白,它们与炭的漂白过程有何不同,为什么?
5、碘化银为什么可用作人工降雨剂?
6、请你设计一个简单的实验来制备溴蒸气、溴化氢气体。
7、造成喷泉的原因是什么?有哪些气体也能发生这一现象?你能归纳出一般的规律吗?若希望让二氧化碳气体也能发生喷泉现象,应该怎么办?
8、若要使碘水褪色,可采用哪些方法(至少6种)?
9、关于氯气的制法:
(1)写出制氯气的化学方程式;
(2)若没有浓盐酸,能否用其它物质来代替?
(3)若没有二氧化锰,能否用高锰酸钾等来代替,为什么?
(4)为了节约药品,能否用制备氧气后的残渣来制取?

- 全部评论(0)
