怎样利用溶度积来判断沉淀的生成和溶解?
时间:2019-06-11 16:33 来源:未知 作者:李浩 点击: 次 所属专题: 沉淀转化 溶度积
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
难溶电解质的沉淀和溶解是化学实验和化工生产中经常遇到的过程。例如氯化物在水溶液中同硝酸银反应,生成氯化银沉淀。
NaCl+AgNO3===AgCl↓+NaNO3
虽然AgCl的溶解度很小,但微溶在水中的AgCl全部电离成Ag+和Cl-。在一定温度下,Ag+和Cl-与AgCl固体之间,处于动平衡状态。
AgCl![]() Ag++Cl-
Ag++Cl-
这是一个多相平衡,达到平衡时的溶液是饱和溶液。这时溶液中的Ag+和Cl-在固体表面上沉淀为AgCl的速率,和AgCl溶解成为Ag+和Cl-进入溶液的速率相等,
V沉淀=V溶解
实验证明,AgCl的溶解速率与AgCl跟溶液接触的表面积S成正比。即:
V溶解=K1S
AgCl的沉淀速率与溶液中Ag+和Cl-各自的浓度以及AgCl跟溶液接触的表面积S成正比。即:
V沉淀=K2[Ag+][Cl-]S
在沉淀和溶解达到平衡时有
K2[Ag+][Cl-]S=K1S
![]()
K1、K2是比例常数,所以KSP也是常数,叫做电解质的溶度积常数,简称溶度积。它在定温下是定值。KSP与物质的溶解度有关,它反映了物质的溶解能力。
根据溶度积的数值,可以判断定温下难溶电解质在溶液中沉淀或溶解的情况。例如在AgCl的溶液中,
若[Ag+][Cl-]<KSP,溶液未达饱和,没有AgCl沉淀析出;如有固体AgCl与溶液接触,则AgCl溶解,直至[Ag+][Cl-]=KSP。
若[Ag+][Cl-]=KSP,溶液已达饱和,既没有AgCl沉淀析出,固体AgCl也不溶解。
若[Ag+][Cl-]>KSP,溶液中溶质的量超过了饱和溶液所能溶解的量,有多余的AgCl沉淀析出,直至[Ag+][Cl-]=KSP。
应用这个原理,就可以控制离子的浓度,使难溶电解质沉淀或溶解。
【例1】在0.01mol/LKCl溶液100mL中,加入0.01mol/LAgNO3溶液1mL,有没有AgCl沉淀析出?(AgCl的KSP=1.8×10-10)
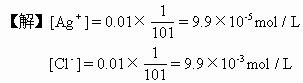
[Ag+][Cl-]=(9.9×10-5)×(9.9×10-3)=9.8×10-7
9.8×10-7>18×10-10,即[Ag+][Cl-]>KSP,故有AgCl沉淀析出。
【例2】在Pb2+浓度为1.5×10-2mol/L的溶液20mL中,加入1mol/LNaCl溶液20mL,有没有PbCl2沉淀析出?
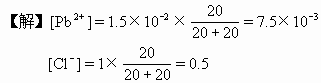
[Pb2+][Cl-]2=(7.5×10-3)(0.5)2=7.5×10-3×0.25=1.9×10-3
PbCl2的KSP=1.6×10-5,现在[Pb2+][Cl-]2>KSP,所以有PbCl2沉淀析出。

- 全部评论(0)
