金属晶体的熔、沸点变化规律
时间:2012-05-21 09:10 来源:未知 作者:姚小伟 点击:次 所属专题: 沸点 熔点 金属晶体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在金属晶体中,金属原子是靠自由电子和金属离子间的相互作用结合在一起的,金属熔化时,金属键并没有被破坏,只是原子间的距离略有增大,当液态金属变为气体时,金属键完全被破坏,分离成单个原子(碱金属蒸气中有少量M2分子),因此,金属的沸点往往比熔点高得多。
1.同周期金属的价电子越多,熔、沸点越高。
金属晶体内自由电子数增多,金属键合能力增强,欲使金属熔化或气化则需较高温度。如Na、Mg、Al,参与成键的电子数增多,且半径减小,故熔、沸点依次升高。
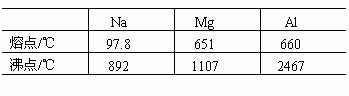
2.同主族金属的半径越大,熔、沸点越低。
同主族金属价电子数相同,半径的增大使得金属键减弱,导致熔、沸点降低,如碱金属从Li到Cs,熔点由180.5℃依次降低,Cs的熔点仅28.4℃,放在手心上就可以熔化。
以上两条规律仅对次外层是稀有气体结构的典型金属是适用的。过渡金属的熔、沸点都很高,熔点普遍超过1000℃,沸点大部分高达3000℃,其中钨的熔点是3380℃,沸点是5927℃,产生这种现象的原因是d电子参与成键,使金属键增强。铜副族因还有部分d电子较活泼,其熔、沸点仍较高,但锌副族的d电子稳定,其熔、沸点明显下降,此后进入了低熔区,低熔区金属的价电子虽不少,但活动性差,不能全部成为自由电子,金属键弱,导致熔、沸点低。
影响金属键强弱的因素
金属键是阳离子与电子之间较强的作用,简单地说,类似于静电作用,所以金属键与金属原子的自由电子数和金属原子半径有关。
(联想物![]()
![]()
例如:Li、Na、K、Rb、Cs金属键依次减弱。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
(100001) 评论 金属晶体的熔、沸点变化规:img src=1
(2162143522) 评论 金属晶体的熔、沸点变化规:高手高手高手
还没有评论,快来抢沙发吧!
