有关电解的问题集
时间:2012-05-21 11:14 来源:未知 作者:郑益强 点击:次 所属专题: 电解池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.电极方程式及电解方程式的写法
电极及电解方程式是重要的化学用语之一,是中学生必须熟练掌握的基础知识。要使学生迅速、准确书写方程式,必须注意以下几点:
(1)看阳极材料是否为惰性电极,如果不是,溶液中的阴离子无需考虑。
(2)熟记阴离子和阳离子的放电顺序。
阴离子:S2->I->Br->Cl->OH-……
阳离子:Ag+>Fe3+>Cu2+>H+……
(3)只要牵涉到水的电解,电极方程式中一律写成OH-或H+放电,而电解方程式中则写成H2O的形式。
例1 用Pt作电极电解CuSO4溶液,写出电极、电解方程式及判断pH变化。
![]()
阳极:4OH--4e=O2↑+2H2O pH下降
阴极:Cu2++2e=Cu pH无明显变化
电解方程式:
![]()
溶液pH下降。
2.电解过程中的有关计算
高考中经常考查的计算类型有:电极析出物的量、电解后溶液中离子浓度的变化、原电池作外电源消耗物质的量的计算。类型虽多,但根本的计算依据是:串联电路中各电极通过的电子的量相等。
例2 Pt作电极电解NaCl和CuSO4的混合溶液,当电路通过4mol电子时,阴阳两极都得到1.4mol气体,电解后溶液的体积为4L,则最后电解质溶液的pH为多少?
解析 阴极:
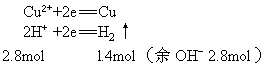
阳极:
![]()
![]()
![]()
解得y=0.6 mol
电解后溶液中:
![]()
pH=13
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
