溶液中离子浓度大小的比较及其规律与应用
时间:2020-03-08 14:17 来源:未知 作者:汪谦 点击: 次 所属专题: 离子浓度大小比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在判断能水解的盐溶液中的离子浓度大小时,首先要明确盐的电离是强烈的,水解是微弱的,其次还要明确多元弱酸盐的水解是分步进行的,而且第一步是主要的,最后不要忘记水的电离。
电离和水解两个过程产生离子或使离子浓度发生变化,所以离子浓度的比较一般从这两方面着眼考查。常见的考查类型有不等式关系的正误判断和等式关系的正误判断两类。
一、不等式关系
(1)多元弱酸溶液
例1.0.1mol/L 的H2S溶液中所存在的离子浓度由大到小的排列顺序是__________.
解析:在H2S溶液中有H2S H+ + HS-,HS-
H+ + HS-,HS- H+ +S2-,因为多元酸的电离以第一步为主,第二步电离较第一步弱的多,但两步都电离产生H+。
H+ +S2-,因为多元酸的电离以第一步为主,第二步电离较第一步弱的多,但两步都电离产生H+。
答案:c(H+)>c(HS-)>c(S2-)>c(OH-)。
点拨:判断多元弱酸溶液中离子浓度大小的一般规律是:(显性离子)>(一级电离离子)>(二级电离离子)>(水电离出的另一离子)
(2)一元弱酸的正盐溶液
例2.0.1mol/L 的CH3COONa溶液中所存在的离子浓度由大到小的排列顺序是______.
解析:在CH3COONa溶液中CH3COONa ==Na+ + CH3COO-,CH3COO-+ H2O  CH3COOH + OH-,从而使c(CH3COO-)降低且溶液显碱性,有c(Na+)>c(CH3COO-),c (OH-)>c(H+)。因盐的水解程度一般较小,则有c(CH3COO-)>C(OH-)。
CH3COOH + OH-,从而使c(CH3COO-)降低且溶液显碱性,有c(Na+)>c(CH3COO-),c (OH-)>c(H+)。因盐的水解程度一般较小,则有c(CH3COO-)>C(OH-)。
答案:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
点拨:判断一元弱酸的正盐溶液中离子浓度大小的一般规律是:(不水解离子)>(水解离子)>(显性离子)>(水电离出的另一离子)
(3)二元弱酸的正盐溶液
例3.0.1mol/L 的Na2CO3溶液中所存在的离子浓度由大到小的排列顺序是_______.
解析:在Na2CO3溶液中Na2CO3 === 2Na+ + CO32-,CO32-+ H2O  HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O  H2CO3 + OH-,CO3-水解使溶液县碱性,有c(OH-)>c(H+)。由于 CO3-少部分水解,有c(CO32-)>c(HCO3-),H CO3-又发生第二步水解,有c(OH-)>c(HCO3-),第二步水解较第一步水解弱的多,那么c(OH-)、c(H CO3-)相差不大,但c(H+)比c (OH-)小的多,因此c(OH-)>c(HCO3-)
H2CO3 + OH-,CO3-水解使溶液县碱性,有c(OH-)>c(H+)。由于 CO3-少部分水解,有c(CO32-)>c(HCO3-),H CO3-又发生第二步水解,有c(OH-)>c(HCO3-),第二步水解较第一步水解弱的多,那么c(OH-)、c(H CO3-)相差不大,但c(H+)比c (OH-)小的多,因此c(OH-)>c(HCO3-)
答案:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)。
点拨:判断二元弱酸的正盐溶液中离子浓度大小的一般规律是:(不水解离子)>(水解离子)>(显性离子)>(二级水解离子)>(水电离出的另一离子)
(4)、二元弱酸的酸式盐溶液
例4.0.1mol/L 的NaHCO3溶液中所存在的离子浓度由大到小的排列顺序是_________.
解析:NaHCO3溶液中存在NaHCO3=== Na+ + HCO3-, HCO3-+ H2O  H2CO3 + OH-,HCO3-
H2CO3 + OH-,HCO3- H+ + CO32-,其水解程度大于电离程度,因此溶液显碱性。有c(OH-)>c(CO32-)。由于少部分水解和电离,则c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)。又因为HCO3-电离产生的H+与CO32-数目相同,而H2O
H+ + CO32-,其水解程度大于电离程度,因此溶液显碱性。有c(OH-)>c(CO32-)。由于少部分水解和电离,则c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)。又因为HCO3-电离产生的H+与CO32-数目相同,而H2O  H+ + OH-因此:c(H+)>c(CO32-)。
H+ + OH-因此:c(H+)>c(CO32-)。
答案:c (Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
点拨:判断二元弱酸的酸式盐溶液中离子浓度大小的一般规律是:(不水解离子)>(水解离子)>(显性离子)>(水电离出的另一离子)>(电离得到的酸跟离子)
多元弱酸的酸式根既能水解又能电离,判断相关离子浓度大小时要掌握两个“量”的问题,其一,水解和次级电离程度都比较小,使产生的新离子浓度比保留下来的旧离子(酸式根)浓度小;其二,多数弱酸的酸式根水解趋势大于电离趋势,使得c(OH-)>c(H+)。中学阶段常见例外的有NaHSO3和NaH2PO4这两种弱酸的酸式盐电离程度大于水解程度,导致其水溶液显酸性。
(5)、不同溶液中同一离子浓度的比较
例5.在相同物质的量浓度的下列各溶液中:①NH4Cl、②CH3COONH4、③NH4HSO4。c(NH4+)由大到小的顺序是___________.
解析:在①中存在NH4Cl===NH4+ + Cl-, NH4+ + H2O  NH3·H2O + H+;在②中存在CH3COONH4 ===CH3COO-+ NH4+,NH4+ + H2O
NH3·H2O + H+;在②中存在CH3COONH4 ===CH3COO-+ NH4+,NH4+ + H2O  NH3·H2O + H+;CH3COO-+ H2O
NH3·H2O + H+;CH3COO-+ H2O  CH3COOH + OH-,在③中存在NH4HSO4===NH4+ + H+ +SO42-;由于③中H+的存在抑制NH4+的水解,因此③中c(NH4+)最大,由于②中存在双水解,促进NH4+水解,故②中c(NH4+)最小。
CH3COOH + OH-,在③中存在NH4HSO4===NH4+ + H+ +SO42-;由于③中H+的存在抑制NH4+的水解,因此③中c(NH4+)最大,由于②中存在双水解,促进NH4+水解,故②中c(NH4+)最小。
答案:③>①>②
点拨:该类型题要看溶液中其它离子对的其影响。
(6)、混合溶液中各离子浓度大小的比较
例6. 0.1mol/L 的NH4Cl溶液和0.1mol/L 的氨水混合溶液中所存在的离子的浓度由大到小的排列顺序是_____________.
解析:在该溶液中,NH3·H2O的电离与NH4+的水解相互抑制,NH3·H2O的电离程度大于NH4+的水解程度,溶液显碱性:c(OH-)>c(H+),同时c(NH4+)>c( Cl-)。要进行综合分析,电离因素、水解因素等都是影响离子浓度大小的要素。
答案:c (NH4+)>c ( Cl-) >c (OH-) >c (H+)。
点拨:常见的醋酸和醋酸钠溶液等浓度共存时,其电离程度大于水解程度,混合液显酸性。
二、等式关系
(1)电荷守恒
电解质溶液中所有阳离子所带正电荷总数与所有阴离子所带负电荷总数相等。例如在NaHCO3溶液中,就存在c (Na+) + c(H+) = c(HCO3-) + c(OH-) + 2c(CO32-)这样的守恒。
例7. 某地的雨水呈酸性,取其少量进行检测,其中含各离子的物质的量浓度分别为:c (Na+)=5.0×10-5mol·L-1,c(Cl-)=7.1×10-5mol·L-1, c(SO42-)=4.5×10-6mol·L-1,c (NH4+)=1.0×10-6mol·L-1,则雨水中氢离子的物质的量浓度是多少?
解析:该题可采用电荷守恒法:c(Na+) + c (NH4+)+ c (H+)酸+ c (H+)水 = c(OH-)水 + c(Cl-) +2c (SO42-),由于溶液显酸性,c(OH-)水 很小,且有:c(H+)水 =c(OH-)水 ,即由水电离出来的氢离子和氢氧根离子的数目相等,故可以略去不计。代入数据有:
5.0×10-5mol·L-1+1.0×10-6mol·L-1+c (H+) = 7.1×10-5mol·L-1+2×4.5×10-6mol·L-1,
解得:c(H+) =2.9×10-5mol·L-1
答案:c(H+) =2.9×10-5mol·L-1
点拨:在解答此题时有的学生往往列出:c(Na+) + c(NH4+)+ c(H+)=c(Cl-) + c(SO42-)而导致计算产生错误,究其原因是对电荷守恒没有理解透彻。电荷守恒是用离子的浓度或物质的量来表示电荷关系的,所以不仅要考虑离子的浓度或物质的量,还要考虑离子所带的电荷。
(2)物料守恒
电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子,但离子或分子中某种特定元素原子的总数是不会改变的。例如在NaHCO3溶液中,n(Na+) : n(C) =1 : 1,推出:c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)。
例8. 写出K3PO4 溶液中存在的物料守恒关系式___________________。
解析:在K3PO4 溶液中,PO43-部分水解成HPO42-、H2PO4-、H3PO4,其物料守恒关系式为:c(K+) =3[c (PO43-) + c(HPO42-) + c(H2PO4-) + c(H3PO4)]=3c(PO43-)+ 3c(HPO42-) + 3c(H2PO4-) + 3c(H3PO4)
答案:c(K+) =3c(PO43-)+ 3c(HPO42-) + 3c(H2PO4-) + 3c(H3PO4)
(3)质子守恒
质子守恒是指电解质溶液中的分子或离子得到或失去的质子的物质的量相等。例如在NH4HCO3溶液中H3O+、H2CO3、为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有c(H3O+)+ c(H2CO3) = c(NH3) + c(OH-) + c(CO32-)。
质子守恒也可理解为电解质溶液中的粒子电离出的H+的总数等于粒子接收的H+的总数再加上游离的H+的总数。如Na2S溶液中的质子转移示意图:
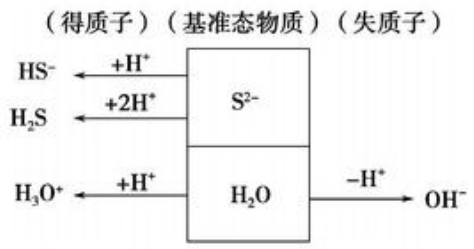
上图不难看出质子守恒的关系式为:
c(H3O+) + c (HS-) + 2c (H2S) = c(OH-)或 c (H+) + c (HS-) + 2c (H2S)= c(OH-)
实际上,质子守恒也可根据电荷守恒和物料守恒联合求出:
在Na2S溶液中的电荷守恒: c(Na+) + c(H+) =c(OH-) + c(HS-) + 2c(S2-)
在Na2S溶液中的物料守恒: c(Na+) =2c(S2-) + 2c(HS-) + 2c(H2S)
将这两式合起来化简得: c(OH-) = c(H+) + c(HS-) + 2c(H2S)
三、综合应用举例
例8. 下列关于电解质溶液中离子浓度关系的说法正确的是
A. 0.1mol/L 的NaHCO3溶液中离子浓度的关系:c(Na+)=c(HCO3-) + c(H2CO3) + 2c(CO32-)
B. 0.1mol/L 的NH4Cl溶液和0.1mol/L 的NH3·H2O等体积混合后离子浓度的关系: c( Cl-)>c(NH4+)>c(H+)>c (OH-)
C. 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)= c(CH3COO-)
D. KHS溶液中存在等式关系:c(S2-) + c(OH-) = c(H+) + c(H2S)
解析:A选项是等式关系,因含有电中性的H2CO3,故是“物料平衡”。原物质NaHCO3中Na+和HCO3-物质的量相等,根据碳原子守恒,A式不成立;B选项关键是NH4+ 与NH3·H2O在互变中的相对程度,作为一个典型的问题要求我们记住结论,铵盐与氨水等浓度时,溶液显碱性,b项错误。由电荷平衡可以得出C选项正确,因为pH=7,c(OH-)= c(H+),代入电荷平衡式:c(Na+) + c(H+) = c(CH3COO-) + c(OH-)就得选项C。D选项中既有电中性的H2S分子,又有OH-、H+,这种式子通常要由溶质的物料平衡和溶液的电荷平衡式叠加得出。电荷平衡式:c(K+) + c(H+) = c(OH-) + c(HS-) + 2c(S2-), 物料平衡式:c(K+)= c(HS-) + c(H2S) + c(S2-);两式联合求出D选项正确。
答案:C、D
例9. 常温下,如果取0.1mol/L 的HA溶液与0.1mol/L 的NaOH溶液等体积混合(忽略混合后体积变化),测得混合后溶液的pH=8,试回答下列问题
(1)求出混合溶液中下列算式的精确计算结果:
c(Na+)-c(A-) = _________ mol/L;c(OH-)-c(HA-) = _________ mol/L。
(2)在含有A-、Na+、H+、OH-的水溶液中,如果出现下列关系,请将它们在溶液中可能对应的溶质分子填在横线上:
① c(Na+)>c(A-)>c(OH-)>c(H+):_________________________;
② c(A-)>c(Na+)>c(H+)>c(OH-):_________________________;
③ c(Na+)>c(OH-)>c(A-)>c(H+):_________________________。
解析:(2)由于Ha与NaOH溶液恰好完全反应,且混合后pH=8,所以为强碱弱酸盐,故HA为弱酸。根据电荷守恒:c(Na+) + c(H+)=c(A-) + c(OH-)得:c(Na+)-c(A-)=c(OH-)-c(H+) =10-6mol/L -10-8mol/L =9.9×10-7mol/L。根据物料守恒得:c(HA) + c(A-) = c(Na+) =0.05 mol/L,联合上两式得出:c(OH-)-c(HA-) = c(H+) =10-8mol/L;
(2)顺序①中显碱性,且c(Na+)>c(A-),可能是单一物质水解平衡,故溶质只能是NaA,若两种物质只能是电离平衡为主,水解为辅,则盐NaA中含有微量NaOH;顺序②中显酸性,且c(A-)>c(Na+),只能是电离平衡为主,水解平衡为辅,两种物质为盐NaA中含酸HA微量,故溶质为NaA和HA。顺序③中显碱性,且c(Na+)>c(A-),只能是电离平衡为主,水解平衡为辅,两种物质为盐Naa中含碱NaOH适量,故溶质为NaA和NaOH。
答案:(1)9·9×10-7;1×10-8
(2)①NaA或NaA和NaOH ②NaA和HA ③NaA和NaOH。
四、高考试题赏析:
【例题1】(2010年上海高考卷16)下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+) + c(HS-) + c(H2S)
解析:氨水和氯化铵混合溶液的pH=7时,溶液中c(OH-)=c(OH-),根据电荷守恒则c(Cl-)=c(NH4+),A错;由于pH=2的酸的强弱未知,当其是强酸正确,当其是弱酸时,酸过量则溶液中c(OH-)>c(OH-),B错;1mol·L-1的硫酸铵溶液中,铵根离子部分水解,根据物质的组成,可知:c(NH4+)>c(SO42-)>c(H+),C对;1 mol·L-1的硫化钠溶液中,根据物料守恒,可知c(OH-)=c(H+) + c(HS-) + 2c(H2S),D错。
答案:C
点拨:此题考查了溶液中的微粒浓度的大小比较。在解答该类的题目时,核心是抓住守恒,其包括:电荷守恒、物料守恒和质子(氢离子)守恒。其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数;物料守恒是指原子个数守恒或质量守恒;质子守恒:是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。
【例题2】(2010四川理综卷10)有关①100 mL 0.1 mol/L NaHCO3、②100 mL0·1 mol/L Na2CO3两种溶液的叙述不正确的是
A.溶液中水电离出的H+ 个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3)
D.②溶液中:c(HCO3-)>c(H2CO3)
解析:本题考查盐类水解知识;盐类水解促进水的电离,且Na2CO3的水解程度更大,碱性更强,故水中电离出的H+ 个数更多,A项正确;B②钠离子的物质的量浓度为0.2 mol/L 而①钠离子的物质的量浓度为0.1 mol/L 根据物料守恒及电荷守恒可知溶液中阴离子的物质的量浓度之和:②>①,B项正确;C项NaHCO3水解程度大于电离所以c(H2CO3)>C(CO32-);D项Na2CO3 中的CO32-分步水解,第一步水解占主要地位且水解大于电离,D项正确。C、D两项写出它们的水解及电离方程式也能判断。Na2CO3的水解:第一步:
CO32-+ H2O HCO3-+ OH-、第二步:HCO-+ H2O
HCO3-+ OH-、第二步:HCO-+ H2O H2CO3 + OH-。
H2CO3 + OH-。
答案:C
五、跟踪练习
【练习1】. 在K2CO3溶液中,下列等量关系正确的是:
A. c (OH-) = c(H+) + c (HCO3-) + c (H2CO3)
B. 2c (Na+) = c(CO32-) + c (HCO3-) + c (H2CO3)
C. c (Na+) + c (OH-) =c(H+) + 2c (CO32-) + 3c (HCO3-) + 4c (H2CO3)
D. c (Na+) + c (H+) =c(HCO3-) + c (CO32-) + c (OH-)
解析:由质子守恒知:A项正确的是 c(OH-) = c (H+) + c (HCO3-) + 2c (H2CO3),由物料守恒知:B项正确的是 c (Na+) =2c (CO32-) + 2c (HCO3-) + 2c (H2CO3),由质子守恒和物料守恒联合推出C项正确,由电荷守恒知:D项正确的是c (Na+) + c (H+) =c(HCO3-) + 2c (CO32-) + c (OH-)。
答案:C
在实际应用中,要结合电解质溶液中盐类水解以及离子浓度大小的比较等方面的知识,在练习过程中加深认识,只有加强训练,才能熟练掌握三个守恒的适用条件,这样才能考出好的成绩。
【练习2】下列浓度关系正确的是
A. 氯水中:c(Cl2)=2[c(ClO-) + c(Cl-) + c (HClO)]
B. 氯水中:c(Cl-)>c(H+ )>c(OH-)>c(ClO-)
C. 等体积等浓度的氢氧化钠与醋酸混合:c(Na+) =c(CH3COO-)
D. Na2CO3溶液中:c(Na+) >c(CO32-)>c(OH-)>c(HCO3-) >c(H+ )
解析:根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2 +H2O HClO + H+ + Cl-,HCl完全电离,而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;C项等物质的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(OH-)>c(H+),再根据溶液中电荷守恒可以判断c(Na+) >c(CH3COO-);
HClO + H+ + Cl-,HCl完全电离,而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;C项等物质的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(OH-)>c(H+),再根据溶液中电荷守恒可以判断c(Na+) >c(CH3COO-);
答案:D正确
点拨:该题重点考查溶液中离子浓度大小比较,只要我们抓住三个守恒一切问题便迎刃而解。
【练习3】向体积为0.05mol·L-1CH3COOH溶液中加入体积为VB的0.05mol·L-1KOH溶液,下列关系错误的是
A. VA>VB时:c(CH3COOH) +c(CH3COO-)>C(K+)
B. VA=VB时:c(CH3COOH) +c(H+)>C(OH-)
C. VA<VB时:c(CH3COO-)> (K+)>c(OH-)> c(H)
D. VA与VB任意比时:c(K+)+ c(H+) = c(OH-)+ c(CH3COO-)
解析:若VA>VB,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05VA,n(K+)=0.05VB,则A选项正确;若VA=VB,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若VA<VB,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
答案:C

- 全部评论(0)
