原电池中盐桥的主要作用
时间:2017-04-26 10:00 来源:未知 作者:汪谦 点击: 次 所属专题: 盐桥 双液电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我们通常见到的铜锌原电池由两个半电池组成的:锌和硫酸锌溶液为负极, 铜和硫酸铜溶液为正极,在两种溶液之同用盐桥相连。盐桥中充满KCl饱和溶液。
为什么要在两个半电池之间架起一个盐桥?盐桥中为什么要用KCl溶液?用其它盐溶液行不行?
显而易见,为防止两种电极液混溶,也不致造成氧化剂(CuSO4)与还原剂(Zn)的直接 反应,就把两个半电池分装于两个杯中。使用 盐桥就沟通了内路,为正负离子向两极定向移 动提供了条件。
能不能通过一个连通管,使ZnSO4溶液与 CuSO4溶液直接接触来沟通电池内路呢?这样 一来,两种溶液之间会形成较大的液接电位,对电极电势产生较大的影响。
什么是液接电位呢?我们来看这样的例 子:若浓度不同的两种HClO4溶液混合时, H+与ClO4-、从浓度大的一边向稀的一边扩散, 但H+的扩散速度比ClO4-大,引起稀的一边出 现过剩H+而带正电,在浓的一边由于过剩的 ClO4-、而带负电,形成电荷分离的双电层。即在两种溶液的界面处出现了电位差。
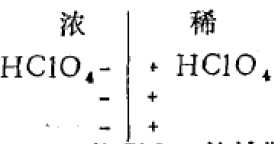
电位差的产生使H+的扩散速度减慢,而使ClO4-的扩散速度加快,最后达到一 个稳定状态。这时,两种离子以相同的速度扩 散,电位差恒定。又如在浓度相同的AgNO3 溶液与HNO3溶液接触时,只是Ag+与H+向相 反方向扩散,因为H+比Ag+扩散速度大得多, 最终也形成一个电位差。象这样在两种不同离 子或两种离子相同而浓度不同的溶液界面上, 存在着微小的电位差,这神电位差称为液体接 界电位,简称液接电位。它是由于离子运动速 度不同而引起的。液体接界电位与离子的浓 度、电荷数、迁移速度以及溶剂性质有关,其 大小一般不超过30毫伏。
K+与Cl-迁移率很接近,故在水溶液体系中通常采用KCl溶液。而且用饱和KCl溶液会 使液接电位小得多。
另外,当饱和KCl溶液与半电池溶液相接 界时,界面的扩散情况主要由盐桥中K+和Cl- 向电极溶液中扩散所决定,而K+与Cl-的迁移 速度相近,产生的液接电位就很小。例如在 25×C 时,0.1mol·L-1 HCl 和0,01mol •L-1HCl相接界时,液接电位为38毫伏,采用饱和 KCl溶液作盐桥后,在盐桥一端液接电位为4.6 毫伏,而在另一端则为3.0毫伏,且在饱和KCl 溶液一侧都带正电,这样相抵消后,总的液接 电位只约为2毫伏,比原先要小多了。
不难想象,在浓度一定,离子迁移速度也 相近的情况下,离子带的电荷越小,产生的液 接电位也越小。故最好选用1—1型盐溶液做盐 桥。如果是AgNO3溶液体系,就不能采用KCl 做盐桥溶液。因为Ag+与Cl_反应生成AgC1沉淀。此时,一般采用NH4NO3或KNO3做盐桥溶液。

- 全部评论(0)
