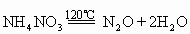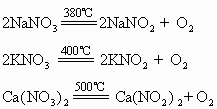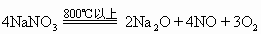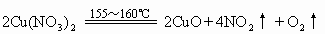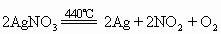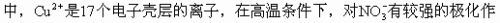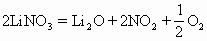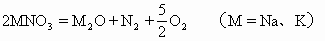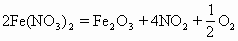硝酸盐的热分解规律
时间:2015-05-24 17:42 来源:未知 作者:万胜 点击: 次 所属专题: 硝酸盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
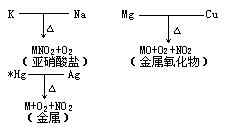
金属活动顺序表中(m(表示金属))
硝酸盐的热分解之二
由于硝酸盐热稳定性差,加热分解时有氧气放出,所以硝酸盐常在高温时作强氧化剂。硝酸盐的热分解规律为:
(1)金属活动性顺序表中从 K到 Mg的硝酸盐加热时生成亚硝酸盐和氧气,如:
(2)金属活动性顺序表中从Mg到Cu(包括Mg和Cu)的硝酸盐加热时生成金属氧化物、二氧化氮和氧气,如:
H在金属活动顺序表中排在 Mg与Cu之间,因而 HNO3受热分解生成NO2、O2、H2O(H的氧化物):
4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
(3)金属活动性顺序表中Cu以后的金属的硝酸盐加热时生成金属单质、二氧化氮和氧气,如:
2AgNO3 2Ag+2NO2↑+ O2↑
2Ag+2NO2↑+ O2↑
对这一规律可以这样理解:
在加热时,各种金属的硝酸盐都是不稳定的,它们首先分解为亚硝酸盐和氧气。金属活动性顺序表中镁以前的金属的亚硝酸盐比较稳定,加热时不再分解;镁和铜之间的金属的亚硝酸盐不稳定,加热时继续分解为金属氧化物和二氧化氮,这些金属氧化物比较稳定,加热时不再分解;铜之后的金属的氧化物也不稳定,加热时再分解为金属单质和氧气。
硝酸盐的分解之三
硝酸盐和其它任何盐一样,随着阳离子的不同,晶体结构的不同,它们的热稳定性也不相同。硝酸盐的热分解,可以有下列几种情况:
(1)硝酸铵
当加热到120℃时,它开始缓慢分解,温度高于180℃时则迅速分解:
如果加热到300℃以上,或在起爆剂的影响下,即发生爆炸反应:
2NH4NO3=4H2O(气)+2N2(气)+O2(气)+56.6千卡
所以硝酸铵可制炸药,它的爆炸危险温度是300℃。由于硝酸铵有很强的吸湿性,农村中使用硝酸铵肥料有时会结块,只能用木棒轻轻压碎,切不可用金属棒敲击,以免引起爆炸。如果夹杂着可燃的物质,则危险性更大。
(2)碱金属和碱土金属的硝酸盐
这类金属的硝酸盐受热分解放出氧气,并转化为相应的亚硝酸盐。例如:
在更高的温度下,这些硝酸盐也可能分解为氧化物、一氧化氮和氧气。例如:
(3)在金属活动性顺序表中位于Mg—Cu之间的金属的硝酸盐
受热分解生成相应的氧化物,并放出二氧化氮和氧气。例如:
(4)在金属活动性顺序表中位于Cu后的金属的硝酸盐受热分解生成金属单质,并放出二氧化氧和氧气。例如:
硝酸盐加热分解所得产物的不同,常从离子极化的观点来理解。在
高温条件下,碱金属离子和碱土金属离子对硝酸根离子的极化作用不够大
用,争夺其中1个氧原子形成氧化物,余下部分形成NO2和O2。对于 AgNO3来说,可设想先有和硝酸铜分解的类似过程。
4AgNO3= 2Ag2O+ 4NO2+O2
但由于Ag+是18个电子壳层的离子,有更强一些的极化变形作用,和O2-相互极化的结果,产生电子的转移而分解成Ag和O2。
2Ag2O=4Ag+O2
硝酸盐的热分解之四
温度不很高时,硝酸盐热分解的产物主要有三种类型:(电极电位顺序)镁以前金属硝酸盐分解为亚硝酸盐和氧,镁和铜之间金属硝酸盐分解为氧化物、二氧化氮和氧,铜以后金属硝酸盐分别为金属、二氧化氮和氧。
1.硝酸锂(锂比镁活泼)热分解生成氧化锂
钠、钾硝酸盐在高温(1100℃)下分解为氧化物
NaNO3、 KNO3分解温度分别为>255℃、> 340℃, NaNO2、 KNO2分解温度分别为>320℃、>350℃。
2.硝酸亚铁热分解生成三氧化二铁
与此类似的是Mn(NO3)2、Sn(NO3)2、Pb(NO3)2,热分解生成的氧化物依次为:Mn3O4、SnO2、Pb3O4。

- 全部评论(0)