关于亚硝酸盐、磷酸盐的一些问题
时间:2021-11-02 10:41 来源:未知 作者:王笃年 点击: 次 所属专题: 亚硝酸钠
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氮族元素是与生活密切相关的一族元素,特别是 NaNO2及磷酸的各种盐,无时无刻不与我们的生活发生联系。
1、NaNO2使人中毒的机制是怎样的?解毒方法是怎样的?
NaNO2中的+ 3价氮不稳定,具有很强的氧化性 (当然也具有还原性,比如被酸性KMnO4溶液氧化为NO3-),误食过量时,NO2-会迅速进入血液,把血 液中的Fe2+氧化,使负责运输O2的血红蛋白转化为 “高铁血红蛋白”,从而丧失运输O2的能力。所以 NaNO2中毒的症状为口唇、指甲及全身皮肤、黏膜出现紫绀,同时会发生头晕、乏力、胸闷、心悸、恶心、腹痛等症状,严重时还会危及生命。一般成年人食用0. 2 g NaNO2就可能出现中毒症状,一次性摄入3 g 以上则可能造成死亡。在怀疑病人发生亚硝酸盐中毒时,应迅速做催吐处理,以免胃里残余的亚硝酸盐继续被血液吸收,然后尽快送医院救治。医疗上一般釆取静脉注射亚甲基蓝的办法救治,利用亚甲基蓝的还原性,将 被NO2-氧化的高铁血红蛋白中的铁还原为Fe2+,使 其尽快恢复运输的能力。
民间有NaNO2致癌的说法,其实这并不准确,NaNO2并不直接导致癌症发生,它进入人体后,与人体内的胺类化合物作用形成的亚硝基胺才是致癌的元凶。美国早年的研究表明,在Vc等还原性维生素存在的条件下,这种转化会被抑制。因此美国规定,肉类制品中(香肠、腊肉、午餐肉罐头等)必须含有质量分数至少为0. 55 g・kg-1的Vc。
2、为什么剩菜里会有亚硝酸盐?
蔬菜中都含有硝酸盐,如果种植过程中过量施用化肥,可能导致NO3-在蔬菜中过量积蓄,蔬菜活体具有新陈代谢能力,体内NO3-浓度会维持一定水平,不 会过高,一旦蔬菜的生命力丧失(被炒熟、被腌制),代谢平衡破坏,它体内的NO3-会被维生素C等还原剂 (对于腌菜来说,可能会有酶的促进作用)逐步还原为NO2-,所以一段时间内NO2-浓度会逐渐升高,一般 在48 h升至最高.其后,由于NO2-具有氧化性,会被还原剂进一步还原为N2等,NO2-浓度随着时间的延长而下降,大概2周后可以降低至无毒、无害水平,这就是为什么腌制的泡菜类食品要在2周后方可食用的原因。所以,隔夜剩菜以及新腌制的泡菜等一般不宜食用,以防发生亚硝酸盐中毒。
3、NaNO2容易使人中毒,为什么还要那么普遍地使用它?
NaNO2具有十分广泛的用途,如生产上用于染料制备、医药合成、印染业的媒染剂和漂白剂等。由于 NaNO2具有使肉类制品增色以及抑菌、防腐的作用, 还常常用于熟肉食品的防腐与发色添加剂。另外, NaNO2作为价格相对便宜的工业盐,过去还被用于建筑业的冬季施工,把它掺入混凝土,可以大大降低水泥砂浆的结冰温度。后因屡次引发工地中毒(工地食堂误用NaNO2替代食盐)事故,目前一般使用尿素等无毒物质降低混凝土凝固点。有些冬季建成的新房空气检测时会有氨气超标等问题,原因就是尿素缓慢水解释放出了氨气。
对于NaNO2的使用不必“谈虎色变”,NaNO2是 合法的食品添加剂,1992年世界卫生组织发布的人体安全摄入NaNO2的标准为0〜0. 1 mg・kg-1。依此标准,一个质量为60 kg 的人,一次摄入NaNO2不超过 6.0 mg就是安全的,不会造成任何危害。在NaNO2 用于食品添加剂时,国家也有明确的限制标准,肉食 中NaNO2最大使用量是0. 15 g・kg-1 ,肉类罐头中 NaNO2残留量不得超过0.05 g・kg-1 ,其他肉制品中 不得超过0. 03 g・kg-1。
有趣的是,NaNO2虽然有使人中毒的危险,却也 被用作氤化物(CN-)中毒的急救药品。医疗上发现氰化物中毒时,往往按照中毒程度,给予静脉注射一定 剂量NaNO2溶液的方法解毒。这是利用了 NO2-中+ 3价氮的氧化性,将剧毒物CN-中一3价的N元素氧化为N2。
从NaNO2的性质和应用可见,化学就是如此神奇的一门科学。
4、关于磷肥加工、施用中的一些问题
磷元素是植物生长必需的元素.磷元素在自然界 主要以磷矿石[Ca3(PO4)2],氟磷灰石[Ca5F(PO4)3]等形式存在,这2种矿物均不易溶于水,难以被农作物直接吸收。自然状态下,这些矿物借助水、空气中 CO2等物质的作用,十分缓慢地发生风化、溶解,使得少量磷进入土壤中,供给植物吸收利用。所以,不施用化肥也能够产出庄稼,只是产量极低。
磷酸是三元酸,它可以形成2种酸式盐一磷酸 一氢盐、磷酸二氢盐,其中绝大多数的磷酸二氢盐是易溶于水的。于是人们想到,使磷矿石、磷灰石转化为磷酸二氢盐,提高作物的吸收效率。一般可用浓硫酸处理磷矿石或磷灰石,把所得固体混合物直接用作肥料:
Ca3(PO4)2+2H2SO4=2CaSO4+Ca(H2PO4)2,
2Ca5F(PO4)3+7H2SO4=7CaSO4+3Ca(H2PO4)2+2HF↑ .
CaSO4与Ca(H2PO4)2固体混合物称为“普通过 磷酸钙",简称“普钙”,也可采用磷酸与磷矿石反应,制取单一成分的 “重过磷酸钙”(简称“重钙”):
Ca3(PO4) 2+ 4H3PO4= 3Ca( H2PO4) 2.
根据各类磷酸盐的性质可知,这些磷肥不宜直接施放到碱性土壤中,因为其中的磷酸二氢钙遇碱易被 转化为难溶性的CaHPO4或Ca3(PO4)2;同理,这类磷肥也不宜和草木灰等碱性肥料混合施用。
5、在一些食品或饮料配方中,常常看到“三聚磷酸钠”、 “焦磷酸钠”等物质,它们有何作用?
三聚磷酸、焦磷酸都是磷酸分子间脱水的产物:
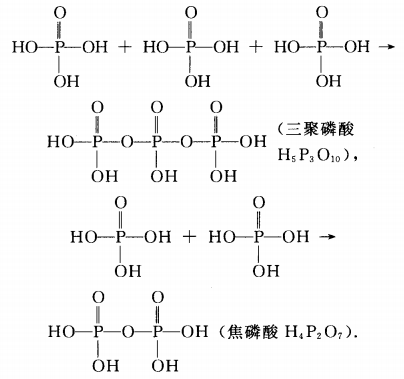
三聚磷酸钠(Na5P3O10).焦磷酸钠(Na4P2O7分别是它们对应的正盐。
首先,根据P3O105-、P2O74-的结构可以判断,它们很容易与水分子间形成氢键,所以三聚磷酸钠、焦磷酸钠都应该具有吸水、保水的性质,这也是它们用于肉类制品、牙膏等的主要作用。其次,P3O105-、P2O74-都 能与Ca2+、Mg2+、Fe2+等离子形成可溶性配合物(螯合物),故有软化硬水的作用,尤其是三聚磷酸钠曾经作为优良的硬水软化剂,广泛添加于合成洗涤剂 中,结果由于生活污水的大量排放,造成了湖泊、近海水质因“富营养化”(磷是植物营养素,水体富含磷会导致藻类大量繁殖,夜晚呼吸消耗O2,使鱼和贝类水生动物窒息而恶化,目前已被限制使用。再次, 它们的水解产物为HPO42-,对溶液的酸碱度具有缓冲作用,具有稳定溶液pH的作用,所以三聚磷酸钠、焦磷酸钠常常用于电镀液配制,也被用作商品饮料的添加剂。它们在饮料中还有另外一个重要作用一一乳化作用,P3O105-、P2O74-等的存在使得饮料中的一些难溶物(脂类、蛋白质等)得以均匀分散开来。
三聚磷酸钠、焦磷酸钠被广泛应用的另一个原因,可能是其水解的最终产物为磷酸根离子(磷酸氢根、磷酸二氢根等)属于无毒、无害物质。

- 全部评论(0)
