硝酸盐受热分解有哪些规律?
时间:2019-11-22 14:48 来源:未知 作者:化学自习室 点击: 次 所属专题: 硝酸盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一般来说,活泼金属的硝酸盐,也就是金属活动性顺序表里钾、钙、钠的硝酸盐,受热时放出氧气并生成相应的亚硝酸盐;在 金属活动顺序表中位于镁和铜之间的金属硝酸盐受热时,生成金属氧化物、二氧化氮和氧气;而铜以后的金属硝酸盐受热时,生成金属单质、二氧化氮和氧气。这个规律可表示如下:
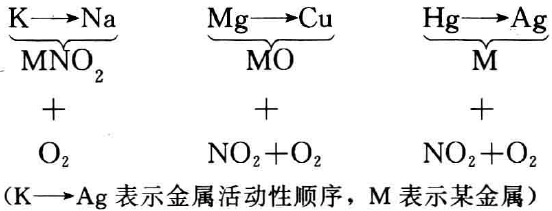
例如:
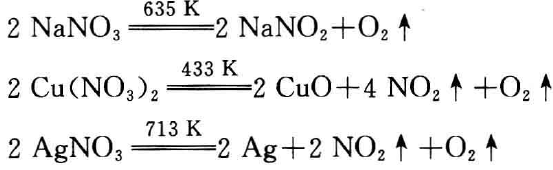
为什么不同的金属硝酸盐受热分解的产物会不同呢?这是因 为结构较复杂的含氧酸盐受热时,离子极化与反极化作用的结果 而引起的。
在高温条件下,碱金属离子和碱土金属离子对NO3-离子的极化作用不够大(这类离子半径相对来说较大),而NO3-离子中![]() 对O2-有较强的相互极化作用,
对O2-有较强的相互极化作用,![]() 从1个氧原子中夺取2个电 子而形成了 NO2-离子和自由的氧,因而碱金属和碱土金属的硝酸盐加热分解的产物是相应的亚硝酸盐和氧气。
从1个氧原子中夺取2个电 子而形成了 NO2-离子和自由的氧,因而碱金属和碱土金属的硝酸盐加热分解的产物是相应的亚硝酸盐和氧气。
但在Cu (NO3)2中,Cu2+是17个电子壳层的离子,在高温条件下,Cu2+离子对NO3-离子有较强的反极化作用。
当没有外界因素影响时,NO3-离子中3个氧原子同样地被氮 所极化;加热时由于离子运动加剧而引起Cu2+离子对NO3-离子 的反极化作用也增强了,对最近的1个O2-离子所产生的感应偶极逐渐将原有氮氧之间的偶极抵消,然后超过原有的偶极。因此,O2-离子与氮间的键大大地被削弱,最后就会引起NO3-离子的完 全破裂,而形成氧化铜、二氧化氮和氧气。
AgNO3受热时,首先有一个和Cu(NO3)2类似的分解过程: 4 AgNO3 = 2 Ag2O+4 NO2 +O2 , 但由于Ag+是18个电子壳层的离子,有更强的极化作用和变形作用,和O2-离子相互极化的结果产生电子转移,生成了单质银和氧:2 Ag2O=4 Ag+O2
这也说明单质银比它的离子更稳定。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
