什么是原子轨道?
时间:2018-08-08 14:48 来源:未知 作者:吴星 点击: 次 所属专题: 原子轨道
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1)原子轨道的概念
在人民教育出版社出版的《物质结构与性质(选修3)》教材中,并没有明确 给出原子轨道的定义,只是说:把电子出现的概率约为90%的空间圈出来,得到描述电子云形状的轮廓图,人们把电子云轮廓图叫做原子轨道。江苏教育 出版社出版的《物质结构与性质(选修)》教材中是这样描述原子轨道的:在含 有多个核外电子的原子中,电子的能量往往是不同的,人们根据电子的能量差异和主要运动区域的不同,认为核外电子分别处于不同的电子层上。处于同 一电子层的原子核外电子也可以在不同类型的原子轨道上运动(这里所说的 原子轨道与宏观物体的运动轨迹不同,它是指量子力学描述电子在核外空间 运动的主要区域)。
实际上,原子轨道是人们描述电子在原子中运动状态所“借用”的一个名 词。测不准原理的要求,意味着一般意义的电子运动轨道不存在。
为了描述原子中电子的运动状态,人们建立了原子中电子运动状态的波 动方程,由波动方程可以解出一系列波函数Ψ(x,y,z)。一个Ψ(x,y,z)代表 了电子在原子中的一种运动状态,由于每一个Ψ(x,y,z)都有3个对应的量子数n、l、 m( n 称为主量子数,表示电子运动区域离核的远近和电子能量的高低;l 称为角量子数,决定电子角动量大小,规定电子运动主要区域在空间的角度分布, 与电子云形状有关;m 称为磁量子数,规定了电子云在空间的不同取向),所以 波函数可写成Ψ n,l,m(x,y,z),把量子数的具体数值或符号代入,波函数又可 表示成如Ψ1s、Ψ2pz、Ψ3dxy等。由于历史的原因(也许是从卢瑟福行星模型和波 尔模型沿袭而来),人们将它们称为原子轨道,如1s轨道、2p轨道等。
从上面的描述可以看出,原子轨道是人们借用来表示波函数的一个代名词。若用球坐标来描述波函数,如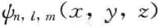 可表示成
可表示成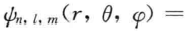
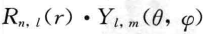 ,这里R(r)称为径向分布函数,Y(θ,φ)称为角度分布函 数。人们的研究还发现,ψ的平方
,这里R(r)称为径向分布函数,Y(θ,φ)称为角度分布函 数。人们的研究还发现,ψ的平方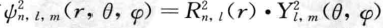 可以表示电子在空间某点出现的几率密度,用点的多少来表示几率密度的大小所得 到的。原子中电子在核外的几率密度图像就是人们常说的电子云,这就是波 函数引伸出的具体意义。
可以表示电子在空间某点出现的几率密度,用点的多少来表示几率密度的大小所得 到的。原子中电子在核外的几率密度图像就是人们常说的电子云,这就是波 函数引伸出的具体意义。
由于在讨论化学键形成时,角度分布函数图像更为重要,加之波函数的概 念中学生也难以理解,因而,中学化学教材中,将电子云图或电子云轮廓图称 为原子轨道,这也是中学化学基础性体现的一种方式。
(2)原子轨道概念的教学要求
根据化学课程标准,在高中“物质结构与性质”选修课程模块中,与原子轨道相对应内容的学习要求如下:
•知道s、p轨道的形状(图3-2列出了常见原子轨道的形状示意图);
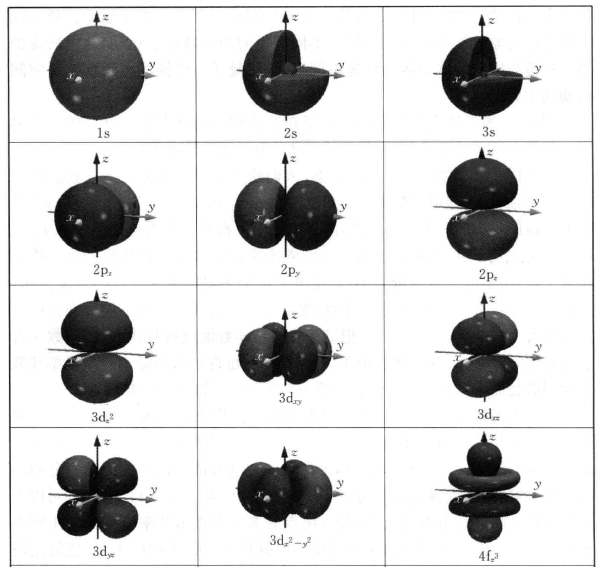
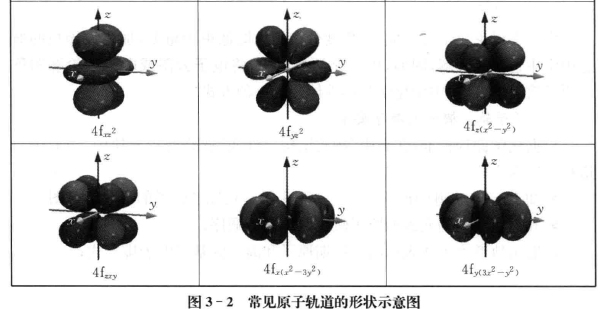
•知道前4周期元素的原子轨道能级高低顺序;
•知道s、p轨道通过不同的重叠方式可以形成θ、π键。
在化学教学中,一定要采用多种方式引导学生加强原子轨道及其应用的认识。由于微观结构的抽象性,高中生对物质的微观结构的认识相对比较困 难,在化学教学中,我们不能拘泥于原子轨道概念的表述,不能要求学生严格 知道什么是原子轨道,原子轨道的定义究竟应该是什么,而应该更多地关注原 子轨道相关知识的应用。例如,让学生知道S轨道都是球形的,p轨道是哑铃 形的;知道每个原子轨道上最多可以容纳2个电子,且同一电子层上p轨道有 3个,d轨道有5个;能根据原子轨道的能级顺序写出1〜36号元素原子或离子 的基态核外电子排布式;知道s- s、s-p轨道可形成c键,p - p轨道根据不同 的重叠方式可形成a、tt键。这样的要求既符合课程标准的要求,又符合学生的认知特点。

- 全部评论(0)
(16627663777) 评论 href="/plus/view.php?aid=17023">什么是原子轨道?:哈哈哈 感觉很友谊5
