如何理解反应热与焓变的单位是kJ/mol?
时间:2020-04-08 20:44 来源:未知 作者:吴星 点击: 次 所属专题: 反应热单位
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在依据化学课程标准编写的中学化学教材中,通常都会有下列热化学方 程式:
2H2(g) + O2(g) =2H2O(1) ΔH =-571. 6 KJ • mol-1
H2(g)++O2(g)= H2O(1) ΔH =-285. 8 KJ • mol-1
在化学教学中,学生们常常会产生下列困惑:在热化学方程式中,ΔH的单位是 kj • mol-1,是指1 mol物质参与反应,还是指生成1 mol物质所产生的热效应?如何理解的单位?要解决这一问题,首先必须了解反应进度的概念'。
对于任一化学反应
aA(g) +bB(g) =gC(g) +hH(g) (1)
a、b、g、h分别为反应物和生成物的化学计量数,设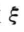 表示反应的进度,在反应开始时(t = 0,t为反应时间),反应进度为零,记作
表示反应的进度,在反应开始时(t = 0,t为反应时间),反应进度为零,记作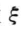 =0,各物质的物质的量分别为叫n0(Δ)、n0(B)、n0(C)、n0(H),当反应进行到某一状态时,体系的反应进度为
=0,各物质的物质的量分别为叫n0(Δ)、n0(B)、n0(C)、n0(H),当反应进行到某一状态时,体系的反应进度为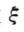 时,各物质的物质的量分别为
时,各物质的物质的量分别为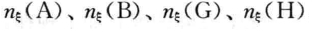 ,则反 应进度
,则反 应进度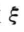 定义为
定义为
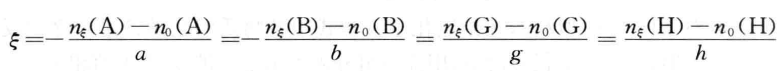
例如,对于反应


从上述例子中可以看出,反应(2)、(3)都是合成氨反应,反应的始态和终 态也都是相同的,所不同的是化学方程式中各物质的计量数,因而反应进度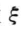 也 不相同。化学反应进度
也 不相同。化学反应进度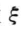 有如下规律:
有如下规律:
•反应进度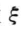 表示反应进行的程度;
表示反应进行的程度;
•对于任一化学反应,按给定化学方程式中各物质的化学计量数之比反应时,在反应的任意时刻,任用任何一组分表示反应进度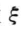 ,其值相等。
,其值相等。
•反应进度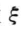 与化学方程式书写有关。
与化学方程式书写有关。
•化学反应按化学计量数之比进行一个单位时,反应进度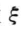 就等于1 mol。 热化学方程式中的焓变ΔH与反应进度
就等于1 mol。 热化学方程式中的焓变ΔH与反应进度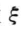 是有关
是有关
2H2 (g) + O2 (g)==2H2O(g) ΔH =-483.6 KJ • mol-1
是指2 mol H2(g)与1 mol O2(g)完全反应,生成2 mol H2O(g)(此时反应进度 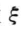 =1 mol)时的火含变。而
=1 mol)时的火含变。而
H2(g) +1/2O2(g) == H2O(g) ΔH =— 241. 8 KJ • mol-1
是指1 mol H2(g)与+mol O2(g)完全反应,生成1 mol H2O(g)(此时反应进度也为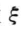 =1 mol)时的給变。
=1 mol)时的給变。
可见,中学化学课程中热化学方程式中的ΔH,从本质上说是指按所给化学方程式的化学计量数之比进行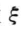 = 1 mol的反应的焓变,这就不难理解热化学方程式中的单位是KJ • mol-1 了。
= 1 mol的反应的焓变,这就不难理解热化学方程式中的单位是KJ • mol-1 了。

- 全部评论(0)
