原电池构成的条件是什么?
时间:2018-08-05 16:38 来源:未知 作者:吴星 点击: 次 所属专题: 原电池条件
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学化学教学中,“原电池原理及其应用”是高中化学课程中电化学知识部分的重要内容。在中学化学的教学中,多数化学教师习惯于帮助学生总 结归纳原电池构成的条件,绝大多数教师将原电池构成的条件总结成:
(1)存在能自发进行的氧化还原反应;
(2)两种活动性不同的金属材料(或一种金属与一种能导电的非金属)作 电极;
(3)有电解质溶液;
(4) 构成闭合电路。
究竟原电池的构成条件是什么?在中学化学中有没有必要向学生讲解原 电池的构成条件?这是高中化学教师必须认识清楚的问题。
在中学化学中通常定义原电池为“能将化学能转化为电能的装置”。严格 意义上说,原电池是一定条件下能自发地将化学能转化为电能的装置,根据化学热力学的原理,一个自发进行的化学反应,ΔG < 0,由于ΔG = - nFE,因而就能在化学变化过程中将化学能转化为电能,从化学反应本质上看,能构成原 电池的条件是:存在一个该条件下自发进行的化学过程。至于这一反应是否是氧化还原反应并不是先决条件。
笔者在听中学化学课时,曾遇到这样的场景,一个化学教师在原电池原理 的复习课上要学生完成下列选择题:
A.Ag+ + Cl-==AgCl
B. NaOH+ HCl==NaCl+ H2O
C. Zn + Cu2+== Zn2++ Cu
D. Cu + 2HCl==CuCl2 + H2
这位教师的命题意图是想让学生运用原电池构成的条件判断题给反应是 否是自发进行的氧化还原反应,因而给出的答案是C,其实反应A、B、C都能 将化学能转化为电能,例如反应A就可以在下列电池中完成(用电池符号表 示):
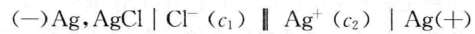
该电池发生的反应如下:
负极反应:Ag -e-+ Cl- =AgCl
正极反应:Ag++e-= Ag
电池反应:Ag++ Cl-==AgCl
化学上可运用该电池反应测定AgCl的溶度积常数Ksp。
因此一个化学反应只要其ΔG<0,理论上都可以实现化学能到电能的转 变,并非一定要是氧化还原反应。
有文献曾经指出:2个相同的锌电极浸入到硫酸铜溶液后,发现电流计的指针偏转了,说明发生了将化学能转化为电能的变化。那么,“两种活动性不 同的金属材料(或一种金属与一种能导电的非金属)作电极”是否是原电池构 成的条件呢?
有这样一个化学问题能更好地回答这一问题,“从一块组成和结构完全均匀的铜板上裁下两块形状和面积相同的铜片,将其中一块铜片用木槌敲打几 下,将两铜片插入硫酸铜溶液中,用导线连接后,电路中有电流通过,哪一块铜片为负极?”答案是经木槌敲打的铜片作负极,理由也很简单:木槌敲打铜片就是对铜片做功,使构成铜片的铜原子核外电子能量升高,铜原子更易失去电 子。因此,两种组成相同的金属或非金属是可以在原电池中作电极的。
在这里有两个问题需要讲明白:
(1)电极反应物(有时称电极活性物质)和电极是两个不同的概念。有许 多电池的电极材料和电极反应物是一致的,如锌锰干电池中的锌,既是负极反 应物(Zn—2e-== Zn2+)又是负极导电材料;有许多电池的电极材料和电极 反应物是不一致的,如氢氧燃料电池,电极反应物分别是氢气和氧气,电极导 电材料都是铂黑。在原电池中唯有金属单质参与电池反应的,通常电极材料 和电极反应物是一致的。
(2) 组成相同的金属活动性不一定完全相同。金属活动性是一个比较模 糊的概念,从热力学活动性看,一般认为同一种金属单质的活动性是相同的, 但动力学活动性就不同了,它不仅与组成有关,还与金属晶体的构型、金属晶 体内部的局部结构、聚集态颗粒的大小等有关,如金属晶体内部的局部结构会 影响金属单质的反应活动性,这就是我们常常见到的一块看似很平整的金属, 在化学反应中,会出现局部地区反应较快的原因所在。
从理论上讲,两块组成、结构完全相同且反应活性也完全相同的金属是不存在的。因此,两块同种元素组成的金属在其可溶性盐溶液中一定能构成原电池。
根据原电池的原理,原电池的两极区必须存在能导电的介质,该导电介质 可以是电解质溶液,也可以是能允许离子通过的固体物质,因此是否有电解质 溶液存在,也不是构成原电池的先决条件。
综合上述分析,我们认为如果一定要讲原电池形成的条件,那就是存在一 个ΔG<0的化学变化。
事实上,《普通高中化学课程标准(实验)》在原电池原理及应用部分的内容标准明确要求:体验化学能与电能相互转化的探究过程,了解原电池和电解 池的工作原理,能写出电极反应和电池反应方程式,认识化学能与电能相互转 化的实际意义及其重要应用。从课程标准看,在中学化学教学中,原电池构成 的条件大可不必向学生讲解得如此“精确”。

- 全部评论(0)
