软硬酸碱规则与配合物的稳定性
时间:2021-05-21 11:10 来源:未知 作者:化学自习室 点击: 次 所属专题: 配合物稳定性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
路易斯酸碱理论是在1923年提出的,其酸碱定义是:凡是能给出电子对的分子、离子或原子团都叫做碱,凡是能接受电子对的分子、离子或原子团都叫做酸,如
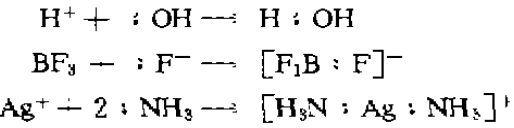
以上反应中H+ 、BF3、Ag+接受电子对是酸,而OH-、F-、N 给出电子对是碱,它们的产物都是配位键形成的“酸碱配合物”。
软硬酸碱是对跑易斯酸碱的进一步分类,是在六十年代提出来的,它是根据路易斯酸的受电子对原子和路易斯碱的电子对原子的按受和给出能力的强弱或难易采取的一种分类方法。
硬酸:受电子对原子( 离子)对外层电子吸引强,其结构特点是正电荷高,体积小,变形低(不一定以上条件同时具备),如H+、Li+、Mg2+、Al3+等。
软酸:受电子对原子(离子)对外层电子吸力弱,其结构特点是正电荷低(或等于零)、体积大、变形性高(不一定以上条件同时具备),如Cu2+、Ag+、Au+等。
硬碱:给电子对原子(离子)对外层电子吸力强,其结构特点是电负性高,变形低.如F-、OH-、O2-等。
软碱:给电子对原子(离子)对外层电子吸引弱,其结构特点是电负性低,变形性高,如I-、CN-、S2-等。
酸碱“软硬”的区分原则是它们是否容易极化变形,难者硬,易者软,而是否容易极化形恰好体现了它们受电子对或给电子对的难易程度,介于软硬之间的酸碱称为交界酸碱。
表 1、表2分别列出—些常见的软、硬、交界酸和欺、硬、变界碱。

根据路易斯酸碱理论,所有的化学反应都被视为酸与碱生成酸碱络合物的反应,软硬酸碱规则揭示了反应的规律:“硬酸倾向于与硬碱结合,软酸倾向于与软碱结合,硬亲硬、 软亲软这一规则仅在于说明硬—硬结合,软—软结构的酸碱配合物它们的稳定性久些,而不是说软硬不能结合,只是结合成的酸碱配合物不太稳定,而且反应较慢。当然地有特例。
在配合物化学中,配合物(配离子)形成体(中心原子或中心离子)是路易斯酸,而配体是路易斯碱,用软硬酸碱规则配合物的形成以及配合物的稳定性是一种比较容易的事情, 其规律是:形成体若为硬酸时,倾向于与硬碱配位体结构,形成体若为软酸,倾向与软碱配位体结合。
根据形成与各种配位能力的比较,将形成体可分为三类,如图L ,未画入图1中的全部金属离子称为第一类配合物形成体,图1中框内的几种元索称为第二类配合物形成体,图1中框外的几种元素称为第三类配合物形成体。上述第一、第二和第三类(也称中间型)形成体分类中,基本分别相当于作为配合物形成体的硬碱、软酸、交界酸。
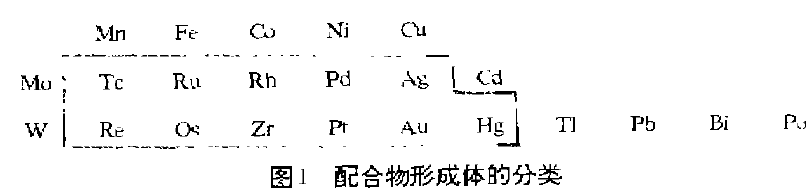
而作为形成体的硬酸与作为配位体的不同碱形成的配合物的稳定性一般舰律为:
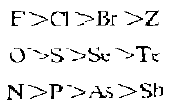
而作为形成体的软酸与作为配位体的不同碱形成的配合物的稳定性一般舰律为:
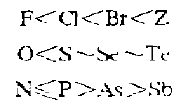
交界酸(碱)与软、硬碱(酸)一般都能配位,形成的配合物的稳定性相差不大 。
根据“硬亲硬、软亲软”的原则,硬酸形成体易与硬碱配位体结合,在配合反应中,硬酸形成体与硬碱H2O的配位能力强于与交界碱NH3的配位能力,这就是在水溶液中硬酸形成体一般不能形成稳定的氨配合物的原因。同样,一般也不与CN- 、S2- 这些软碱形成配合物或沉淀,即使在CN-、S2-浓度很大的碱性溶液中,硬酸形成体也会优先与硬碱配位体形成羟基配合物或氢氧化物沉淀。
软酸形成体在水溶液中能与NH3配位,与CN-、S2- 的结构也强于OH-。
对具有多种氧化态的金属元素。作配合物形成体时,氧化态越高,其酸亦越硬,往往与硬碱配位体结合,而氧化态低的(软酸)往往趋向于与软碱配位体结合。
如:Fe3++6F- [FeF6]3-
[FeF6]3-
Fe+5CO Fe(CO)5
Fe(CO)5
从配合物形成体与配体所形成的化学键的键型考虑软硬酸碱规则,硬酸形成体与硬碱配位体趋向于形成离子键,这是由于硬酸形成体还电荷高、体积小变形性低,而硬碱配位体电负性高,变形性低所致。而软酸形成体与软碱配位体趋向于形成共价键,这是由于软酸形成体正电荷低,体积较大,变形性高,而软碱配位体电负性低,变形性高所致。
从热力学角度考虑软硬酸碱规则,发现硬—硬、软—硬和软—软配合反应的驱动力是不同的。
表3列举了几个配合反应在298K下的热力学函数

由表3看出。所列配合反应的ΔG皆为负值 说明在标态下反应都是自发的.但目发的驱动力却不同。对于1、2硬—硬反应,它们的 ΔH为正值或负值较小,而ΔS皆为较大的正值,所以硬酸—硬碱的反应为熵驱动反应,温度越高反应程度越大。对于4、5软—软反应,它们的 ΔH很负,ΔS很小,所以软酸一软碱的反应为焓驱 动反应,温度升高对反应程度影响不大。对3软—硬反应是属熵驱动还是属焓驱动表现并不十分突出。
用软硬酸碱规则说明配合物的稳定性,其出发点是以配合物形成体与配位体问配位键的形成难易以及键强度为基础的。虽然热力学可作出定量判定,但规则毕竟只作出定性说明,这种规则是对一般情况,而且例外不少,因为使配合物中形成体与配位体间化学键是混合型的,有共价成分也有离子成分, 只是其百分含量不同。 晶体场理论,分子轨道理论,配位场理论等可从不同侧面说明配合物的稳定性。

- 全部评论(0)
(1132911690) 评论 href="/plus/view.php?aid=17390">软硬酸碱规则与配合:nb你这文章直接给我整吾了加油
