强烈双水解一定生成氢氧化物吗?
时间:2020-04-14 09:37 来源:一个芦老师 作者:芦峰 点击: 次 所属专题: 双水解反应 氢氧化物沉淀
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
本文来自微信公众号:一个芦老师,作者:芦峰
多数学生有一个错误的认知:金属阳离子与弱酸根阴离子发生强烈双水解时,金属阳离子得到氢氧化物,酸根得到对应的弱酸。很多同学还会去死记硬背能够强烈双水解的离子,如:
Al3+与CO32- 在水中生成Al(OH)3
Al3+与SO32- 在水中生成Al(OH)3
实际上,上述阴、阳离子在水溶液中确实不能够大量共存,但不是仅仅生成Al(OH)3这样简单,而是得到碱式盐,如:
Al3+与CO32-在水中生成(1-x)Al2(CO3)3·xAl(OH)3
Al3+与SO32- 在水中生成(1-x)Al2(SO3)3·xAl(OH)3
其中x的值与溶液中Al3+、CO32-或SO32-,以及OH-的浓度有关。当然如果溶液的碱性较强,也可以得到Al(OH)3(即认为此时x的值为1)。
我们如何理解呢?实际上,这是一种平行的竞争关系。例如Al3+与CO32-在水中的反应,是下面几个平行反应同时进行得到的:
阳离子水解:Al3++3 H2O Al(OH)3↓ + 3 H+
Al(OH)3↓ + 3 H+
阴离子水解:CO32-+ H2O HCO3-+OH-
HCO3-+OH-
HCO3-+ H2O H2CO3+OH-
H2CO3+OH-
复分解:2 Al3++3 CO32- == Al2(CO3)3↓ + 3 CO2↑
实际上,上述几个反应中的产物,都有可能生成,最终得到的就是碱式碳酸铝(1-x)Al2(CO3)3·xAl(OH)3。同学们可曾想过:为什么九年级的教材中,溶解性表里不存在CuCO3的溶解性?这并不是因为CuCO3不存在,而是因为Cu2+和CO32-在水溶液中会得到碱式碳酸铜。
学习自然科学(尤其是教学层面),可以有学段本身的局限性,但是不能有错误,要尊重自然,尊重科学。如果偏离了对事实的尊重,则会在高考中犯下错误,下面的两道题目,对本文的内容进行了直接的考查。
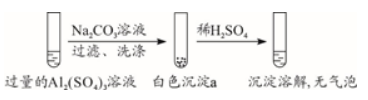
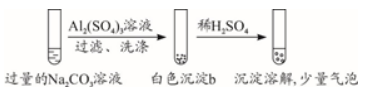
例1.某学生探究0.25 mol·L-1Al2(SO4)3溶液与0.5 mol·L-1Na2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析不正确的是()
A.实验1中,白色沉淀a是Al(OH)3
B.实验2中,白色沉淀b中含有CO
C.实验1、2中,白色沉淀成分不同,与混合后溶液的pH有关
D.检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
答案选D,B项则指沉淀为碱式碳酸铝。
例2.[2016年北京卷节选]向2 mL0·2 mol/L Na2SO3溶液中滴加0.1 mol/L Al2(SO4)3溶液,对于沉淀中亚硫酸根的存在形式提出两种假:
I.被Al(OH)3所吸附;
II.存在于铝的碱式盐中。
对假设II设计了对比实验,证实了假设II成立。
A.将对比实验方案补充完整。
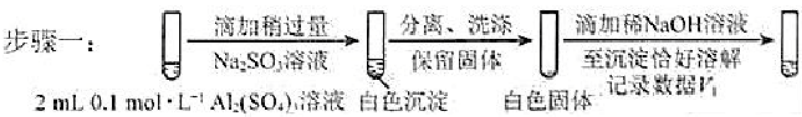
步骤二:________________________________________(按上图形式呈现)。
B.假设II成立的实验证据是________________。
答案:①Al3+、OH-
②B.V1明显大于V2

- 全部评论(0)