全面剖析大π键
时间:2021-03-29 10:17 来源:未知 作者:杨群 点击: 次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【方法与规律】
1、大π键的定义
在多原子分子中,如有相互平行的p轨道, 它们连贯地“肩并肩”地重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键或共轭大π键
2、大π键的形成条件
(1)所有参与形成离域π键的原子在同一平面上,因此中心原子采取sp2杂化或sp杂化
(2)参与形成离域π键的原子都必须提供一个或两个相互平行的P轨道
(3)形成离域π键的P轨道上的电子总数小于P轨道数的2倍
3、大π键表示方法:
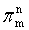 ,m为原子个数,n为共用电子个数,m≤2n
,m为原子个数,n为共用电子个数,m≤2n
如: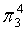 指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4
指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4
4、m和n的计算方法
(1)ABn型的分子或离子
【方法一】
①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3
②n值的计算
A.分析出参与形成离域π键的每个原子形成几个σ键
B.形成σ键后,若只有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多有一对孤对电子参与形成大π键
物质 | 分析方法 | 大π键 |
SO2 | S、O原子的电子式分别为: |
|
O3 | O原子的电子式分别为: |
|
NO2- | N、O原子的电子式分别为: |
|
规律 | ①若微粒互为等电子体,则大π键是相同的;②若为离子,n的数值遵循“阴加阳减” | |
CO2 | C、O原子的电子式分别为: |
|
同理 | SCN-、NO2+、N3-互为等电子体,则大π键是相同的,大π键为 | |
物质 | 分析方法 | 大π键 |
CO32- | C、O原子的电子式分别为: |
|
同理 | NO3-、SO3互为等电子体,则大π键是相同的,大π键为 | |
【方法二】
①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3
②n值的计算(3个部位加起来的总和)
A.中心原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数
B.成键原子=成单电子数总和
C.外界:阴阳离子,遵循“阴加阳减”
物质 | 分析方法 | 大π键 |
SO2 | ①S的杂化:sp2 ②形成大π键的p轨道电子总数 A.中心S原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 6-2×1-2= 2 B.成键原子=2×1= 2 C.外界:0 n=2+2= 4,因此SO2大π键为 |
|
NO2+ | ①N的杂化:sp ②形成大π键的p轨道电子总数 A.中心n原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 5-2×1-0 = 3 B.成键原子=2×1= 2 C.外界:-1 n=3+2-1= 4,因此NO2+大π键为 |
|
SO3 | ①S的杂化:sp2 ②形成大π键的p轨道电子总数 A.中心S原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 6-3×1-0= 3 B.成键原子=3×1= 3 C.外界:0 n=3+3 = 6,因此SO3大π键为 |
|
NO3- | ①N的杂化:sp2 ②形成大π键的p轨道电子总数 A.中心N原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 5-3×1-0= 2 B.成键原子=3×1= 3 C.外界:1 n=2+3+1= 6,因此NO3-大π键为 |
|
【方法三】
①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3
②n值的计算
A.先计算微粒的总价电子数(a)
B.计算原子之间的σ键,一对σ键存在2个电子(b)
C.中心原子的孤对电子数(c)
D.外围原子的价层电子中的孤对电子数,如:O原子为2s、2p中各有1对,共4个电子(d)
③n=a-b-c-d
物质 | 分析方法 | 大π键 |
SO2 | 总价电子数a=6+6×2=18 σ键电子数b=2×2=4 中心原子的孤对电子数c=2 外围原子的价层电子中的孤对电子数d=2×4=8 n=a-b-c-d =18-4-2-8= 4,因此SO2大π键为 |
|
NO2+ | 总价电子数a=5+6×2-1=16 σ键电子数b=2×2=4 中心原子的孤对电子数c=0 外围原子的价层电子中的孤对电子数d=2×4=8 n=a-b-c-d =16-4-0-8= 4,因此NO2+大π键为 |
|
SO3 | 总价电子数a=6+6×3=24 σ键电子数b=3×2=6 中心原子的孤对电子数c=0 外围原子的价层电子中的孤对电子数d=3×4=12 n=a-b-c-d =24-6-0-12=6,因此SO2大π键为 |
|
NO3- | 总价电子数a=5+6×3+1=24 σ键电子数b=3×2=6 中心原子的孤对电子数c=0 外围原子的价层电子中的孤对电子数d=3×4=12 n=a-b-c-d =24-6-0-12= 6,因此NO3-大π键为 |
|
(2)多个中心原子(AmBn)型的分子或离子(用方法一)
①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3
②n值的计算
A.分析出参与形成离域π键的每个原子形成几个σ键
B.形成σ键后,若只有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多有一对孤对电子参与形成大π键
物质 | 分析方法 | 大π键 |
| C原子的电子式为: |
|
| C、N原子的电子式为: 还有3个电子,有一个成单电子参与形成大π键,所以n=5×1+1= 6,因此其大π键为 |
|
| C、N原子的电子式为: |
|
| C、N原子的电子式为: |
|
| C、O原子的电子式为: |
|
| C、S原子的电子式为: |
|
| C、Se原子的电子式为: |
|
| C原子的电子式为: |
|

- 全部评论(0)
(374542117) 评论 href="/plus/view.php?aid=19401">全面剖析大π键:很好,受益匪浅
(3281162536) 评论 href="/plus/view.php?aid=19401">全面剖析大π键:不错,非常有用
 、
、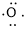 ,中心原子S采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故n=2+2×1= 4,因此SO2大π键为
,中心原子S采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故n=2+2×1= 4,因此SO2大π键为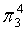
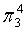
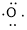 ,中心原子O采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,中心O原子最多提供1对孤对电子形成大π键,配位O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故n=2+2×1= 4,因此O3大π键为
,中心原子O采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,中心O原子最多提供1对孤对电子形成大π键,配位O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故n=2+2×1= 4,因此O3大π键为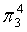

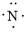 、
、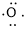 ,中心原子N采取sp2杂化,形成2个σ键,还有3个电子则有1个单电子,中心N原子最多提供1个单电子形成大π键,配位O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,由于带一个单位的负电荷,也要参与形成大π键,故n=1+1+2×1= 4,因此N
,中心原子N采取sp2杂化,形成2个σ键,还有3个电子则有1个单电子,中心N原子最多提供1个单电子形成大π键,配位O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,由于带一个单位的负电荷,也要参与形成大π键,故n=1+1+2×1= 4,因此N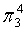
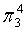
 、
、 ,中心原子C采取sp杂化,形成2个σ键,还有2个电子即1对孤对电子,中心C原子最多提供1对孤对电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,由于带一个单位的负电荷,也要参与形成大π键,故n=2+2×1= 4,因此CO2大π键为
,中心原子C采取sp杂化,形成2个σ键,还有2个电子即1对孤对电子,中心C原子最多提供1对孤对电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,由于带一个单位的负电荷,也要参与形成大π键,故n=2+2×1= 4,因此CO2大π键为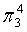
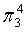
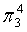
 、
、 ,中心原子C采取sp2杂化,形成3个σ键,还有1个单电子,中心C原子最多提供1个单电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则3个O原子的单电子参与形成大π键,由于带2个单位的负电荷,也要参与形成大π键,故n=1+2+3×1= 6,因此C
,中心原子C采取sp2杂化,形成3个σ键,还有1个单电子,中心C原子最多提供1个单电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则3个O原子的单电子参与形成大π键,由于带2个单位的负电荷,也要参与形成大π键,故n=1+2+3×1= 6,因此C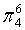
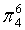
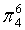
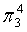
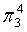
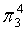
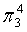
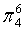
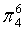
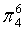
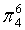
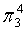
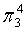
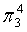
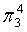
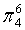
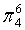
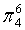
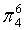
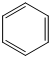
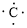 ,每个C原子采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,因此其大π键为
,每个C原子采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,因此其大π键为
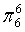
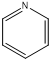
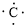 、
、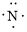 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,N原子形成2个σ键,
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,N原子形成2个σ键,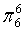
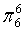
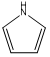
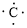 、
、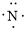 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,N原子形成3个σ键,还有1对孤对电子,这对孤对电子一定参与形成大π键,所以n=4×1+2= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,N原子形成3个σ键,还有1对孤对电子,这对孤对电子一定参与形成大π键,所以n=4×1+2= 6,因此其大π键为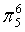

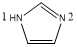
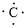 、
、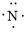 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,1号N原子形成3个σ键,还有1对孤对电子,这对孤对电子一定参与形成大π键,2号N原子形成2个σ键,还有3个电子,则有一个成单电子参与形成大π键,所以n=3×1+2+1= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,1号N原子形成3个σ键,还有1对孤对电子,这对孤对电子一定参与形成大π键,2号N原子形成2个σ键,还有3个电子,则有一个成单电子参与形成大π键,所以n=3×1+2+1= 6,因此其大π键为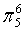
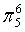
 、
、 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,O原子形成2个σ键,还有4个电子即2对孤对电子,O原子最多提供1对孤对电子形成大π键,所以n=4×1+2=6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,O原子形成2个σ键,还有4个电子即2对孤对电子,O原子最多提供1对孤对电子形成大π键,所以n=4×1+2=6,因此其大π键为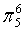
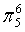
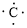 、
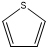
、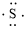 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,S原子形成2个σ键,还有4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键,所以n=4×1+2= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,S原子形成2个σ键,还有4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键,所以n=4×1+2= 6,因此其大π键为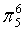
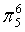
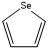
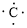 、
、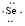 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,Se原子形成2个σ键,还有4个电子即2对孤对电子,Se原子最多提供1对孤对电子形成大π键,所以n=4×1+2= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,Se原子形成2个σ键,还有4个电子即2对孤对电子,Se原子最多提供1对孤对电子形成大π键,所以n=4×1+2= 6,因此其大π键为


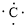 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,所以n=4×1=4,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,所以n=4×1=4,因此其大π键为