强酸制弱酸的原理及其应用
时间:2021-03-29 10:52 来源:未知 作者:化学自习室 点击: 次 所属专题: 强酸制弱酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学化学中,我们经常听到这样的一种说法强酸制弱酸。那么强酸制弱酸到底是什么原理呢?怎么用?
我们先来看一道题,向氯化钡溶液中通入二氧化硫,会有白色沉淀产生吗?有相当多的一部分同学会认为发生如下反应:SO2+H2O+BaCl2=BaSO3↓+2HCl
很多同学觉得这个反应符合初中所学的复分解反应发生的条件,生成沉淀,生成气体,生成水,满足三者之一,反应就能发生。这个反应中生成了亚硫酸钡沉淀,所以反应能够发生。
实际上这个反应是不能发生的,原因就是上述方程式违背了强酸制弱酸原理。具体来说就是亚硫酸是一种弱酸(Ka1=1.23×10-2),不能制备强酸盐酸(相当于K无穷大)。
所谓的强酸制弱酸,指的是较强酸(可以是强酸或弱酸)可生成较弱酸。即:
强酸+弱酸盐→弱酸+强酸盐;
较强酸 + 弱酸盐 →较弱酸+弱酸
学习了选修四第三章后,可以进一步总结为:
没有K的制有K的,K大的制K小的。
常见的酸酸性强弱顺序:
(H2SO4、HCl)>(H2SO3、H3PO4、CH3COOH)>( H2CO3)>( H2S、HClO、苯酚)>( HCO3-)>( H2SiO3、)【在这里,酸性的外延扩展了,能提供H+的化合物就是酸。】
这个顺序说白了就是酸的电离平衡常数的大小顺序。
强酸制弱酸原理的应用主要体现在以下几个方面:
1. 实验室制取某些弱酸
(1)实验室制二氧化碳: 2HCl + CaCO3 =2H2O + CO2↑+ H2O
(2)二氧化硫的制备: Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(3)硫化氢气体的制备:FeS+ H2SO4=FeSO4+H2S↑
(4)3H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO4(强酸制弱酸酸)
(5)硅酸制备:Na2SiO3+2HCl=H2SiO3↓+NaCl或Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
2. 解释现象
漂白粉久置失效的原因:
2Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO +2H2O
2HClO=2HCl+O2↑(反应条件光照)
建筑用的粘合剂水玻璃久置会变质:
Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3
SiO32-+CO2+H2O=H2SiO3↓+CO32-
3. 产物的判断
①向NaAlO2溶液中通入少量的二氧化碳
2NaAlO2+3H2O + CO2=2Al (OH)3↓+ Na2CO3
②向NaAlO2溶液中通入过量的二氧化碳
NaAlO2+2H2O + CO2=Al (OH)3↓+ NaHCO3
③向Na2SiO3溶液中通入少量的二氧化碳
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
④向Na2SiO3溶液中通入过量的二氧化碳
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
⑤向C6H5ONa溶液中通入二氧化碳:
C6H5ONa+ CO2+H2O =C6H5OH+ NaHCO3
不管CO2是否过量,都生成NaHCO3。
4. 酸性强弱的比较
例题:为了确定CH3COOH、苯酚及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
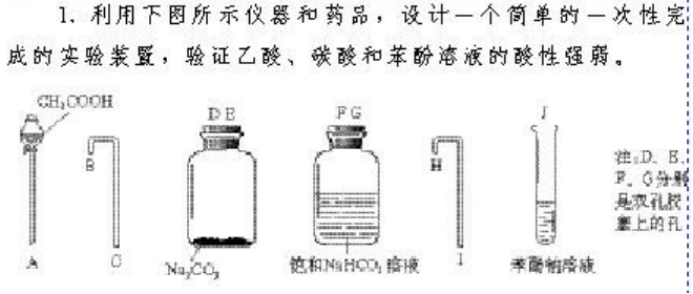
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________.
(2)装置B中盛放的试剂是________,它的作用是__________________________.
(3)实验中观察到C中出现的主要现象是_________________________________.
【答案及解析】
答案:(1)2CH3COOH+CO32-―→2CH3COO-+H2O+CO2↑
(2)饱和NaHCO3溶液 除去CO2中可能混有的CH3COOH
(3)C中溶液变浑浊
解析:苯酚的酸性比H2CO3的弱,故将CO2通入苯酚钠溶液中可制得苯酚,从而证明酸性H2CO3>苯酚.因此装置A的目的是制取CO2,锥形瓶中装有一种易溶于水的正盐固体,即为Na2CO3,分液漏斗中盛放的为CH3COOH,二者反应的化学方程式为2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑.装置B中盛放的是饱和NaHCO3溶液,目的是除去CO2中混有的CH3COOH.
5. 除杂问题中试剂的选择
弱酸(或弱酸的酸酐)中含有较强酸(或较强酸的酸酐)杂质,通常选择弱酸所对应的酸式盐,利用强酸制弱酸的原理除去杂质。 例如:
| 物质 | 杂质 | 所选试剂 | 化学方程式 |
| CO2 | HCl | 饱和NaHCO3溶液 | NaHCO3+HCl=NaCl+CO2↑+H2O |
| CO2 | SO2 | 饱和NaHCO3溶液 | 2NaHCO3+SO2=Na2SO3+2CO2↑ |
| SO2 | HCl | 饱和NaHSO3溶液 | NaHSO3+HCl=NaCl+SO2↑+H2O |
| H2S | HCl | 饱和NaHS溶液 | NaHS+HCl=NaCl+H2S↑ |
也有特例:H2S+CuCl2=CuS↓+2HCl (弱酸制强酸的典型反应)。这个反应可以用平衡的观点来解释。
小结:强酸制弱酸是指的在复分解反应中,在氧化还原反应中就可以弱酸制备强酸了!比如,氯水中通入二氧化硫,反应是二氧化硫+水+氯气=硫酸+盐酸。对于氧化还原反应来说,发生的原理是氧化能力强的制备氧化能力弱的。(另一种强制弱)。

- 全部评论(0)
