第七讲:学会原子结构、元素周期表、元素周期律、化学键
时间:2021-04-21 14:47 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 化学键 元素周期律 原子结构03 元素周期表
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
学习这一部分内容主要尝试解决的问题是,找到物质表现出一些化学性质的原因,也找到物质表现出一些物理性质的原因。
当然,这一部分还对物理中的原子物理、量子学、电学、光学也有重要的支持作用。如物质的得失电子的数量、能力热效应与电学中的电压、电流等有关系,电子的能级跃迁与物理中的光、波及其频率等有关系,原子结构的细分与量子、原子物理有关系。
生物学的高级基础研究,也需要用到这些知识。
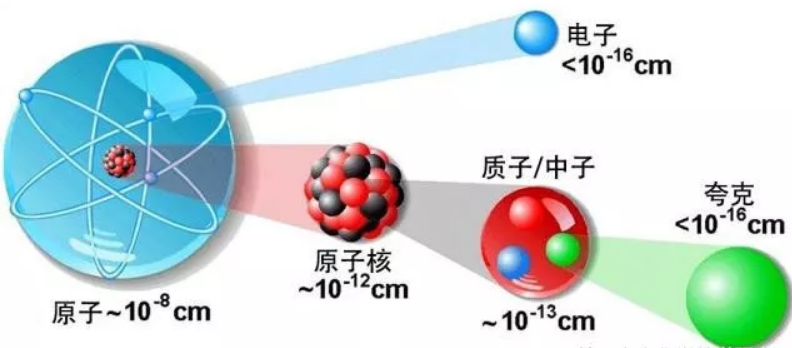
1、原子结构、元素周期表、元素周期律、化学键的关系。
对物质进行结构分析是解决找到物质参与各种化学反应的原因的方法。物质结构分析的起点,是原子结构的分析。
原子的最外层电子的周期性变化,原子对应的单质及化合物的物理性质和化学性质的周期性变化,促使科学家制作了元素周期表。
元素周期表中这种周期性的规律,又使科学家发现了更多的元素和物质。
同时,化学反应不是以原子为基础,而是以单质、化合物形成的物质为基础,从原子到单质或化合物这些物质,中间的联系桥梁是化学键。不仅是化学键,物质的聚集状态对化学性质的表现也有影响。
比如,固体碘单质的化学性质的表现,不仅受碘原子的最外层电子数的影响,还受碘分子I2中两个碘原子之间的共价键的影响,还受固体碘单质中碘分子I2之间的分子间作用力的影响。结果是固体碘的反应活性,比碘原子的要低很多。
2、原子结构需要学会的内容。
(1)原子结构:
①知道原子由原子核(包括质子和中子)和电子(又叫核外电子)构成。
②知道质子数决定的是原子属于哪种元素,质子数和中子数一起决定的是某元素的一种原子(核素),核外电子决定了原子的化学性质。
③知道原子序数=核内质子数=核电荷数=原子核外电子数,知道质量数=质子数+中子数。
(2)核素:知道一种元素可以有多种原子(核素)。
①同种元素的每种原子也叫××核素,同种元素的不同原子(核素)之间互称同位素。如氧元素有三种原子,分别是16O核素(又叫氧-16核素)、17O核素、18O核素。
②同种元素的不同核素对应的单质及化合物的化学性质基本相同。在化学反应时,只要没做特别说明,不区分核素。
在书写表达时,核素容易制造辨别难度。如H2、D2、T2、HD、DT、HT都是指氢气。H2O、T2O、HDO、DTO等都是指水分子。
(3)核外电子排布规律:
要学会规律,明白规律的原因,学会如何书写原子结构示意图。
①核外电子的排布规律:电子先从内层开始填充,每层最多不超过2n2个,最外层不超过8个(次外层不超过18个,倒第三层不超过32个)。
②规律原因:电子的填充规律能使原子处于最稳定状态,又叫最低能量状态。内层比外层的能量低。(选修三的第一章中的构造原理和能量最低原理中讲得更为详细,也略有不同)
每层不超过2n2个、最外层不超过8个等的原因,用选修三的第一章中的构造原理、泡利原理、洪特规则能解释。
③会利用规律推理和书写原子结构示意图。如53号碘元素的原子结构示意图
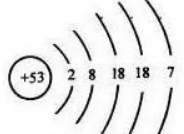
书写方法是:一边按2n2个电子从内到外填入各电子层,一边计算剩余电子数,填完后,再用最外层不超过8个(次外层不超过18个,倒第三层不超过32个)进行检查修改即可。
3、元素周期表需要学会的内容。
(1)知道元素周期表的结构,七个横行指七个周期,十八个纵列包括七个主族(A)、七个副族(B)、一个VII族(有三列)和一个O族。每一横行有多少个元素,与某电子层的最大电子数有关。
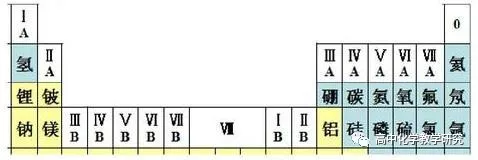
(2)理解元素的原子结构与周期表的关系
会利用主族元素的原子结构示意图推理元素在周期表中的位置。(在选修三中副族也能判断)
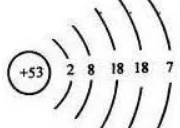
例如根据碘的原子结构示意图,碘元素应该在第五周期(五层),VIA族(第七主族)(最外层有7个电子),也就是在元素周期表中第五行,第十七列的位置。
(3)熟记前二十号元素的汉字、化学符号、原子序数。
会用原子序数推理它们的原子结构示意图、在周期表中的位置,并能达到熟记程度。最好会画元素周期表和快速填入前20个元素中的任意一个。(学完选修三后要求前35个元素)
(4)知道周期或族中各元素在原子结构上的相同点和不同点
同一周期的元素,原子的电子层数相同,最外层电子数不同。
同一族的元素,原子的电子层数不同,最外层电子数相同。(副族元素的次外层电子数也相同,镧系元素和锕系元素的倒数第三层上的电子数也相同,但都有个别例外)
4、元素周期律需要学会的内容。(族的规律也放在这儿)
元素周期律指元素的性质随着元素的原子序数的递增呈周期性变化的规律。需要注意的是元素的性质包括原子的性质、单质的性质及其对应的化合物的性质。
(1)学会周期律和族规律:
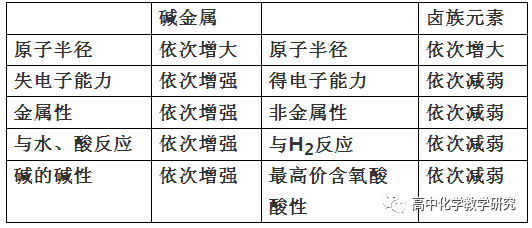
①周期律(同一周期内,从左到右,以第三周期为例)
最外层电子数依次增多。
原子半径依次减小。如r(Na)>r(Mg)>r(Al)>r(Si)>r(P) >r(S) >r(Cl)。
核对核外电子的吸引能力逐渐增强。
失电子能力逐渐减弱,得电子能力逐渐增强。(指原子)
金属性逐渐减弱,非金属性逐渐增强。(含义很广)
金属对应的碱的碱性逐渐减弱NaOH>Mg(OH)2>Al(OH)3,非金属对应的最高价含氧酸的酸性逐渐增强H2SiO3<H3PO4<H2SO4<HClO4。
金属与水或酸的反应能力逐渐减弱,非金属与H2的反应能力逐渐增强。
非金属氢化物的稳定性逐渐增强SiH4<PH3<H2S<HCl。
②族规律(碱金属族和卤素元素,从上到下)
除了原子半径是依次增大外,其它的规律与周期律的规律原因相同。
(2)学会规律产生的原因(按最外层变为8个电子时稳定,不考虑形成共用电子对)
原子变为化合物时,使最外层电子数趋向为变为8个。
一个原子少于4个电子时,以失电子为主。多于4个电子时,以得电子为主。
①有两种根本原因。
一种是最外层电子越少时越容易失去电子,越多时越容易得到电子。
另一种是电子层数越多,原子半径越大时,越容易失去电子。电子层数越少,原子半径越小时,越容易得到电子。这两种原因导致了金属性和非金属性的变化,也导致了原子、单质、化合物的性质的变化。
周期律的产生是由于第一种原因。族的规律的产生是由于第二种原因。
②注意原因的解释和如何回答此类问题。
I、对于周期来说:
核电荷数的增加,导致了原子核对核外电子的作用力的增强。
原子核对核外电子的作用力的增强,导致了原子半径的减少。
最外层电子数的增加和核对电子作用力的增强,导致了失电子更困难和得电子的更容易。
失电子的更困难导致了金属性的减弱,得电子的更容易导致了非金属性的增强。
金属性的减弱导致了金属与水或酸反应的能力减弱和氢氧化物碱性的减弱。非金属性的增强导致了非金属与H2反应的能力增强和最高价含氧酸的酸性的增强。
对于碱金属和卤素元素对应的族来说:
除了起始原因是由于原子的电子层数的增多所导致之外,其它的推理过程相同。
II、回答以上规律的原因时,采用就近原则,也就是用离问题最近的原因来回答。
例如,为什么碱的碱性越来越强?因为对应的金属的金属性越来越强。
为什么金属性越来越强?因为原子的失电子能力越来越强。
为什么原子的失电子能力越来越强?因为原子半径越来越大(或最外层电子数越来越少)。
(3)一些特殊的问题
①离子的半径比较:核外电子排布完全相同时,核内质子数越多,半径越小。因为核电荷数越多,核对电子的作用力越强,离子半径就越小。如离子半径:O2->F->Na+>Mg2+>Al3+。
②O和F没有最高价含氧酸,也没有最高正价。
③比较金属性、非金属性的其它方法
金属性:还可以用金属活动性顺序、置换反应、原电池电极的活泼性(有例外,如Mg、Al|NaOH溶液电池),金属离子的氧化性(Fe3+除外)等。
非金属性:非金属关于氧化性的置换反应、非金属离子的还原性。
④比较金属性、非金属性时常见的几种错误:
根据Cu+2FeCl3=CuCl2+2FeCl2,得到Cu的金属性大于Fe。错在不是利用置换反应进行比较。
根据2C+SiO2=高温=Si+2CO↑,得到C的非金属性大于Si。错在不是利用非金属的氧化性进行比较,而且此反应利用的高温下的挥发性。
根据2HCl+CaCO3=CaCl2+H2O+CO2↑,得到Cl的非金属性大于C。错在不是利用最高价含氧酸进行比较。
5、周期表和周期律的综合应用
(1)主族元素最高正价和最低负价的判断:
最高正价=最外层电子数,最低负价=最外层电子数-8。
金属只有正价态,非金属既有正价,又有负价。
(2)用元素周期表和元素周期律,可以预测新元素,可以推测元素的原子结构,可以推测元素对应的单质及化合物的性质。也可以利用性质来寻找一些元素对应的单质及化合物。
如砷34As,位于第四周期VA族。最高正价是+5,最低负价是-3。单质的氧化性比磷差,氧气会氧化砷化物。氢化物为AsH3,稳定性比NH3差,水溶液可能有碱性。最高价含氧酸为H3AsO4,是弱酸,与强碱能反应,稳定性很差,对应的盐Na3AsO4与强酸能发生反应。As单质介于金属和非金属之间,可能有半导体的性质。
6、化学键需要学会的内容。
(1)化学键及分类
①化学键指原子、离子、原子团、分子之间在构成单质或化合物等物质时,形成的强烈的相互作用力,包括离子键、共价键、金属键等。
②离子键是指离子之间通过静电作用形成的化学键。如NaCl中Na+与Cl-之间。
离子键存在于离子化合物中。常见的离子化合物主要包括由金属阳离子或NH4+对应的化合物(AlCl3除外)。
③共价键是原子之间通过共用电子对形成的化学键。如Cl2中的两个氯原子之间,HCl中的氢原子和氯原子之间。
共价键存在于非金属单质、共价化合物或离子化合物的原子团中。常见的共价化合物主要包括除NH4+之外的非金属化合物(包括AlCl3)。
共价键根据键的极性分为极性键和非极性键。
极性是指由于共价键两端的原子对共用电子对的拥有能力不同,导致共用电子偏向于一侧,偏离的原子带少量正电荷,偏向的原子带少量负电荷的现象。
若由同种原子形成的共价键是非极性键。如H2、Cl2。由不同种原子形成的共价键是极性键。如HCl。
(2)离子键、共价键的形成原因
①当原子最外层不是8个电子时(前四个元素不是只有L层上的2个电子时),原子在自然界中不能稳定存在。
要想稳定存在,要么得失电子变为离子形成离子化合物,要么与别的原子共用电子形成共价化合物或单质。
②当一个原子易失去电子变为阳离子,而另一个原子易得到电子时变为阴离子时,形成离子键。如Na与Cl,变为Na+和Cl-,形成离子化合物NaCl。
当两个原子都不易失去电子时,就采用形成共用电子对的方式形成共价键。如Cl与Cl,形成Cl2。又如H与Cl,形成HCl。
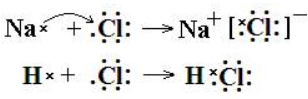
教材中用上面的电子式来书写离子键或共价键的形成过程,目的是为了让学生对键的形成过程和原因产生思考和体验。
在用电子式书写形成过程时,一边要想象每个原子的核外电子分布,一边思考、推理和计算得失电子数或形成共用电子对数,一边书写,这才会有效果。
(3)分子间作用力和氢键
由分子构成的物质,如果分子之间距离较近,分子之间会产生一种较弱的作用力,这种作用力叫分子间作用力,又称范德华力。相对分子质量越大,分子之间的距离越小,分子间作用力越大。一般来说,分子间作用力比化学键的强度要小。
有些带有H的分子与带有N或O或F的分子之间会产生一种特殊的分子间作用力,这种作用力叫氢键。分子间氢键的产生会使熔沸点变高。
【练习】
1、原子的结构中质子决定 ,质子和中子一起决定 ,电子决定 。18O2-的质子数 ,中子数 ,电子数 。
2、写出S2-、K+、Mg2+的半径从大到小的排列顺序: 。
3、S与Cl2若能发生反应,会形成 。K与Cl2发生反应,会形成 。(离子键或共价键)
4、用电子式写出Na2S的形成过程。
5、画出52号元素X的原子结构示意图。这种元素在元素周期表中的位置是 。它的氢化物的化学式为 ,它的氢化物的稳定性比H2O 。
它的最高价氧化物对应的水化物为 ,此水化物的酸性比H2SO4 。
【练习答案】
1、元素,核素(原子),化学性质。8,10,10
2、S2->K+>Mg2+。
3、共价键。离子键。
4、
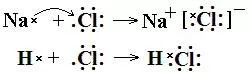
5、
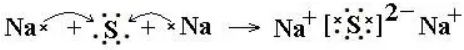
第五周期VIA族。H2X,差。H2XO4,差。

- 全部评论(0)
