第八讲:原子结构和化学键中的几个难点问题
时间:2021-04-21 14:46 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 化学键 原子结构03
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
本讲主要解决关于相对原子质量的几个概念问题,电子式的书写方法,熔沸点的比较方法,电子空间分布与分子空间结构之间的关系。
1、学会区分原子的质量、原子的相对原子质量、元素的相对原子质量、原子的近似相对原子质量、元素的近似相对原子质量这五个概念。
(1)原子的质量:指原子的真实质量。目前主要由质谱仪测得。如12C原子的质量为1.993×10-26kg。
(2)原子(核素)的相对原子质量:用原子的实际质量与12C原子的实际质量的1/12相比较所得的数值。如3517Cl、3717Cl的相对原子质量分别为34.969,36.969。
(3)元素的相对原子质量:指该元素中各核素的相对原子质量的平均值。用该元素中各核素的相对原子质量与各核素所占的个数百分比乘积后再加和得到。它就是在元素周期表中查到的相对原子质量,如氯的35.45。
(4)原子的近似相对原子质量:就是指原子的质量数。质量数不大时,该数值与原子的相对原子质量近似。
(5)元素的近似相对原子质量:用该元素中各核素的质量数与各核素所占的个数百分比乘积后再加和得到的数值。
2、电子式的书写方法
(1)简单的离子化合物的书写方法
首先把握离子化合物的书写格式,如NaCl的电子式为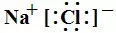 或
或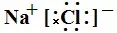 :单原子的阳离子没有中括号,没有电子,有电荷。单原子的阴离子有中括号,有电子,有电荷。多原子的阳离子和阴离子都有中括号,有电子,有电荷。
:单原子的阳离子没有中括号,没有电子,有电荷。单原子的阴离子有中括号,有电子,有电荷。多原子的阳离子和阴离子都有中括号,有电子,有电荷。
书写方法:先推理出原子最外层变为8个电子失去或得到的电子数,阳离子写出对应的离子,阴离子周围点上8个电子,加上中括号,再写上电荷数。如MgO:Mg最外层有2个电子,要失去2个电子,写Mg2+,O最外层有6个电子,要得到2个电子,写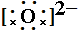 ,合起来写为
,合起来写为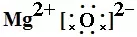 。
。
又如MgCl2的电子式为
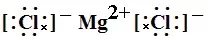
(2)简单的共价化合物的书写方法
首先把握共价化合物的书写格式,如HCl的电子式为![]() 或
或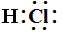 :没有电荷,没有中括号,只有电子。
:没有电荷,没有中括号,只有电子。
书写方法:共价化合物电子式的书写很重要的一点是每个原子形成8电子稳定结构需要几个电子,就会在其周围形成几对共用电子。再计算每个原子自身的剩余电子数,计算方法是自身的最外层电子减去自己周围的共用电子对数。然后点好即可。如N2、NH3、CO2电子式书写过程:
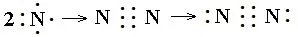
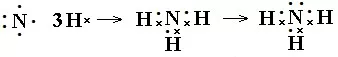
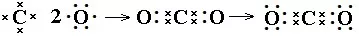
(3)带有共价键的离子化合物的书写方法
先推理形成离子失去或得到的电子数,再计算阳离子或阴离子的原子团中原子失去或得到电子后,还需要形成的共用电子对数,再根据共价化合物的书写方法,写出阳离子或阴离子的电子式,最后写出化合物的电子式。如Na2O2电子式书写过程:
2Na各失去1个电子后,变为2Na+。2个O共得到2个电子后,每个O最外层为7个电子,需要形成一对共用电子:
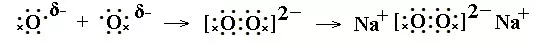
3、熔沸点的比较问题
(1)要解决熔沸点的比较,先要学会对常见的宏观物质按组成和作用力进行分类。
气体:由分子构成,分子与分子之间无作用力。除稀有气体(单原子分子)外,分子内部有共价键。如O2、CO2。
液体:由分子构成,分子与分子之间有分子间作用力或氢键,分子内部有共价键。如H2O、苯、CCl4。(不包括汞)
固体(晶体):分为四种。离子晶体,由离子构成,作用力为离子键,原子团离子中含共价键,如Na2SO4。原子晶体,由原子构成,作用力为共价键,如金刚石、晶体硅、SiC、SiO2。分子晶体,由分子构成,分子之间为分子间作用力,分子内部为共价键,如碘晶体等除原子晶体之外的非金属单质和共价化合物。金属晶体,由金属原子构成,作用力为金属键,如金属铜等各种金属。
(2)结构相似的宏观物质的熔沸点比较
离子晶体之间的比较:电荷数大的,熔沸点高,MgO>NaF。离子半径小的,熔沸点高,如NaCl>KCl。
原子晶体之间的比较:原子半径越小的,熔沸点高。如金刚石>SiC>晶体硅。
分子晶体:相对分子质量大的,熔沸点高。如CCl4>CH4,C3H8>CH4,CS2>CO2,I2>Br2>Cl2。
有氢键的,熔沸点高。如H2O>H2S(H2O中有氢键),HF >HCl(HF中有氢键)。
(3)溶沸点与稳定性的区别
熔沸点是物理性质,稳定性是化学性质。熔沸点的大小比较要用上面的理论推理。稳定性的比较要靠第五讲中化合物的不稳定性的规律及原因进行推理。
4、电子分布与分子空间结构之间的关系。
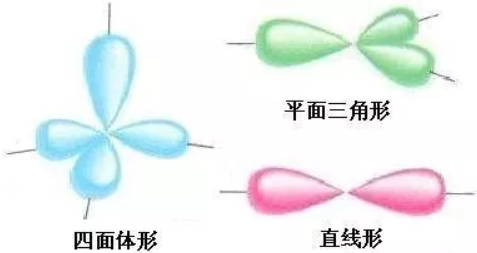
(1)中心原子的四对电子以四个单对的形式出现时,以正四面体的形式分布在原子周围,若有的电子对的另一端有原子,会形成不同的空间结构,如CH4的正四面体形结构、NH3的三角锥形结构、H2O的V形结构。
(2)中心原子的四对电子以两对电子合在一起与另外两个单对的形式出现时,以平面三角形的空间分布状态存在。如HCHO(甲醛)的平面三角形结构,C2H4(乙烯)的平面长方形结构。
(3)中心原子的四对电子以各两对电子合在一起,或以三对电子合在一起与另外一对电子的形式出现时,以直线型的空间分布状态存在。如CO2的直线形结构,HCN的直线形结构,C2H2的直线形结构。
对于更多种类的特殊键型和特殊分子结构,在本讲座中不做分析。(对于选修三中更细的内容,也不做分析)
【练习】
1、氯有35Cl和37Cl两种核素,在自然界的个数比为3:1,则氯元素的近似相对原子质量为 。
2、写出CS2、HCN、NH4Cl、CaC2、NaOH的电子式。
3、下列物质只有非极性键的是,只有极性键的是 ,既有离子键又有极性键的是 ,既有离子键又有非极性键的是 。
①NH3②O2③Na2O2④NH4Cl
4、按熔沸点从高到低的顺序排列
①KF和CaO。②金刚石和晶体硅。③HCl和HBr。④PH3与NH3。
5、写出下列分子的空间构型。
①PH3。②CCl4。③H2S。④CsCl2。⑤CS2。
【练习答案】
1、35.5
2、
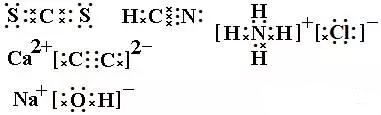
3、②,①,④,③
4、①CaO>KF,②金刚石>晶体硅,③HBr>HCl,④NH3>PH3
5、①三角锥形。②正四面体形。③V形。④平面三角形。⑤直线形。

- 全部评论(0)
