关于沉淀溶解平衡的问题
时间:2021-11-01 16:16 来源:未知 作者:王笃年 点击: 次 所属专题: 溶解平衡
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题1、Ksp与 溶 解 度 (S)哪 一 个 更 科 学、更 准确?为什么先学习了S 后又要学习Ksp?
对于任何“固体—液体”混合体系而言,结晶(沉淀)—溶解平衡是客观存在的规律,当溶液中溶质粒子的浓度较小时,主要发生溶解过程,当溶液中粒子浓度过大时,则主要发生结晶(沉淀)过程。
这个规律与固体物质的溶解性(溶解度大小)无关,比如,向 NaCl饱和溶液中通入HCl气体或者投入金属钠,均可导致NaCl的析出,如图1、2所示.

因为HCl溶解度大,它溶解 后,饱 和 NaCl溶液里 Cl-浓度显著增大,导致NaCl(s) Na+(aq)+Cl-(aq)平衡向左移动,因此有 NaCl析出;
Na+(aq)+Cl-(aq)平衡向左移动,因此有 NaCl析出;
将金属钠投入到饱和食盐水中,Na与水剧烈反应生成溶解度很大的 NaOH,溶液中 Na+浓度显著增大,同样导致上述平衡向左移动,因此有 NaCl析出(当然,水与钠反应会消耗掉一部分,也会导致 NaCl析出)。
中学课程里之所以先学习S后学习 Ksp,是沿着人类认识世界的过程和规律设计的。因为早期人们曾经错误地认为有些固体不溶于水,后来技术发展了,人们可以通过测量难溶物水溶液的电导率等得知,其实不溶于水的物质也具有一定的溶解性,因此才逐步明白“没有绝对不溶的物质”,只是物质的溶解度大小不同而已。
问题2、Ksp主要受哪些因素影响?
Ksp是一个平衡常数,对于确定的反应式(即固体的溶解平衡表达式)而言,它应该只受温度的影响。对于溶解过程吸热的物质来说,随着温度的升高 Ksp逐渐增大,如 AgBrO3;而 对于溶解过程 放 热 的 物 质 来说,则 Ksp随温度升高而减小,如Ca(OH)2。
问题3、BaCO3、PbS溶解形成的 CO32-、S2-会水解,其 Ksp又该如何计算?
这是一个很好的问题,Ksp叫作“溶度积常数”,与溶液里实际存在的各离子浓度直接关联。对于溶解后产 生的离子 均 游离存在于溶液中的物质 (如Mg(OH)2、BaSO4等),无疑可根据其溶解度估算 其Ksp,当然,也可依据其 Ksp估算其溶解度。但是,对于上述 BaCO3、PbSO4等物质,它们溶解产生的阴、阳离子会因发生水解而使浓度减小,这时,物质的溶解度 S与Ksp之间的关系就不再那么简单了,如果仍依据溶解度S 的数据估算Ksp,求得的 Ksp值将比实测值大。
下面以 BaCO3为例计算。
已知 BaCO3的溶解度为0.002 2g(每100g 水).若简单地认为 BaCO3(s) Ba2+(aq)+CO32-(aq),则 Ksp=c (Ba2+)·c (CO32-)=c2(Ba2+)=(
Ba2+(aq)+CO32-(aq),则 Ksp=c (Ba2+)·c (CO32-)=c2(Ba2+)=(![]() )2=1.2×10-8;实际上 CO32-会发生水解反应,导致饱和溶液 中c(Ba2+)≠ c(CO32-)。而Ba(OH)2为强碱,Ba2+不会水解,其 浓 度 依 然 是
)2=1.2×10-8;实际上 CO32-会发生水解反应,导致饱和溶液 中c(Ba2+)≠ c(CO32-)。而Ba(OH)2为强碱,Ba2+不会水解,其 浓 度 依 然 是![]() =1.1×10-4 mol·L-1.依据 HCO3-的 Ka=4.3×10-11,可 算 出 CO32-的水解常数 Kh=Kw/Ka=2.3×10-4.
=1.1×10-4 mol·L-1.依据 HCO3-的 Ka=4.3×10-11,可 算 出 CO32-的水解常数 Kh=Kw/Ka=2.3×10-4.
按下式可粗略计算水解掉的 CO32-浓度 x(之所以说“粗略计算”,是因为忽略了其第二步水解,即不考虑 CO32-水解产生的 HCO3-的进一步水解作用):
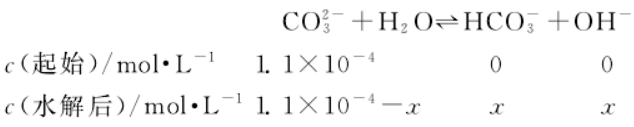
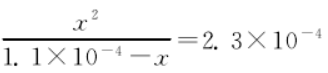
解得 x=8.2×10-5
溶液中 CO32-实际浓度为 1.1×10-4 mol·L-1-8.2×10-5mol·L-1=2.8×10-5 mol·L-1。故 BaCO3实际的 Ksp(BaCO3)=c(Ba2+)c(CO32-)=3.1×10-9,此值显然小于忽略CO32-水解作用简单计算所得的1.2×10-8。
问题4、既然 Ag+很容易与 NH3结合形成配离子 Ag(NH3)2+,配 制 银 氨 溶 液 过 程 中,将 氨 水 加 入AgNO3 溶液初期为什么不直接形成 Ag(NH3)2+,而先变为 AgOH(Ag2O)之后再溶解?
这是一个稍微复杂一点的问题,涉及多重平衡,分析如下:
假 设 AgNO3 溶 液 的 浓 度 为 0.1 mol·L-1,AgOH 的 Ksp=2.0×10-8,Ag(NH3)2+的稳定常数K稳 =1.9×1010,NH3·H2O 的电离常数 Kb=1.8×10-5,即有如下关系:
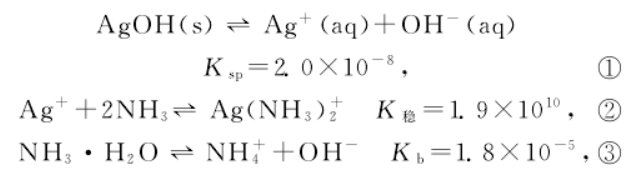
根据式①可知,要生成 AgOH沉淀,只要求溶液中 OH-浓度达到2.0×10-7mol·L-1即可,根据式③可知,只需要极稀的氨水(2.02×10-7mol·L-1)即可达到 该 要 求根据式 ② 可 知,在 0.1 mol·L-1的AgNO3 溶液 中,要 生 成 Ag(NH3)2+(假 设 有1% 的Ag+转化为配离子即为有配离子生成),NH3的浓度要求 达 到7.3×10-7 mol·L-1.此 浓 度 值 要 比 生 成AgOH 要求的2.02×10-7 mol·L-1高得。
NH3·H2O 是弱电解质,在越稀的溶液里,电离程度越大.所以,开始阶段滴加的氨水,主要用于电离产生 OH-以满足形成 AgOH 反应的需求,此过程中绝大多数的 Ag+都转化为 AgOH 沉淀,游离的 Ag+浓度下降,导致 Ag(NH3)2+形成要求的 NH3浓度越来越大.只有当 Ag+完全沉淀为 AgOH 后,氨水的浓度 超 过 一 定 值 时,才 会 发 生 AgOH → Ag+→Ag(NH3)2+的反应。
问题5、定量分析实验中洗涤 BaSO4 沉淀时,为什么要用硫酸铵溶液?
分析化学里测定、Ba2+或 SO42-含量时,常常根据BaSO4 的 稳 定性采用重量分析 法:将 它 们 转 化 为BaSO4 沉淀,过滤、洗涤、高温灼烧(使无灰滤纸彻底烧掉变为挥发性的 H2O、CO2)、冷却、称量。为使所得BaSO4的质量准确,过滤步骤完成后一般要洗涤沉淀表面残留的可溶性盐.用水洗容易造成BaSO4 的微弱溶解,所以 一 般采用浓度较 大 的(NH4)2SO4 溶液洗涤沉淀,这样通过提高洗涤液 中SO42-浓度的方法抑制 BaSO4的溶解平衡向右移动,为什么要用(NH4)2SO4 溶液呢?用Na2SO4 溶液不行吗?
显然,用 Na2SO4 溶 液 不行! 因为残 留的Na2SO4 必将导致沉淀物质量变大、引起误差。采用硫酸铵则没有问题,因为高温灼烧过程中,硫酸铵可彻底分解变为挥发性气体而不影响 BaSO4的质量测定。
3(NH4)2SO4 22↑+SSO2↑+4NH3↑+6H2O
22↑+SSO2↑+4NH3↑+6H2O

- 全部评论(0)
