重要的元素化合物化学方程式总结
时间:2022-08-04 16:38 来源:未知 作者:化学自习室 点击: 次 所属专题: 元素化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、碱金属
1.钠露置在空气中变暗:
4Na + O2= 2Na2O
2.钠的燃烧(工业生产过氧化钠):
2Na + O2 Na2O2
Na2O2
3.钠与硫混合爆炸:
2Na + S = Na2S
4.钠投入水中:
2Na + 2H2O = 2NaOH + H2↑
5.钠投入硫酸铜溶液中:
2Na + CuSO4+2H2O = Na2SO4+Cu(OH)2↓+ H2↑
6.过氧化钠与水反应:
2Na2O2+2H2O = 4NaOH + O2↑
7.过氧化钠与二氧化碳反应:
2Na2O2+2CO2= 2Na2CO3+O2
8.碳酸氢钠与氢氧化钠溶液反应:
NaHCO3+NaOH = Na2CO3+H2O
9.碳酸氢钠溶液与盐酸反应:
NaHCO3+HCl = NaCl + H2O + CO2↑
10.向碳酸钠溶液中逐滴加入盐酸:
Na2CO3+HCl(少量)= NaCl + NaHCO3
盐酸足量时:Na2CO3+2HCl(足量)=2NaCl + H2O + CO2↑
11.少量石灰水与碳酸氢钠溶液反应:
Ca(OH)2+2NaHCO3= CaCO3↓+ 2H2O + Na2CO3
离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
12.足量石灰水与碳酸氢钠溶液反应:
Ca(OH)2+NaHCO3= CaCO3↓+ H2O + NaOH
离子方程式:Ca2++ OH-+ HCO3-=CaCO3↓+ H2O
13.少量氢氧化钠与碳酸氢钙溶液反应:
Ca(HCO3)2+NaOH = CaCO3↓+ NaHCO3+H2O
离子方程式:Ca2++ OH-+ HCO3-=CaCO3↓+ H2O
14.足量氢氧化钠与碳酸氢钙溶液反应:
Ca(HCO3)2+2NaOH = CaCO3↓+ Na2CO3+2H2O
离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O + CO32-
15.侯德榜制碱法:
①向NaCl溶液中先通入NH3后通入CO2:
NH3+CO2+NaCl + H2O = NaHCO3↓+ NH4Cl
②碳酸氢钠受热分解:
2NaHCO3 Na2CO3+CO2↑+ H2O
Na2CO3+CO2↑+ H2O
16.向饱和碳酸钠溶液中通入二氧化碳气体:
Na2CO3+CO2+H2O= 2NaHCO3↓
二、卤素
1.钠在氯气中燃烧:
2Na + Cl2 2NaCl
2NaCl
2.铜在氯气中燃烧:
Cu + Cl2 CuCl2
CuCl2
3.铁在氯气中燃烧:
2Fe + 3Cl2 2FeCl3
2FeCl3
4.铁与溴单质反应:
2Fe + 3Br2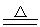 2FeBr3
2FeBr3
5.碘与铁反应:
Fe + I2 FeI2(Fe与I2反应时,Fe只能生成+2价)
FeI2(Fe与I2反应时,Fe只能生成+2价)
6.氯气与氢气混合光照:
H2+Cl2 2HCl(爆炸)
2HCl(爆炸)
7.工业制盐酸:
H2+Cl2 2HCl
2HCl
8.氯气与磷点燃:
2P + 3Cl2(少量) 2PCl3(液);
2PCl3(液);
2P + 5Cl2(足量) 2PCl5(固)
2PCl5(固)
9.氯气使湿润布条褪色(氯气溶解于水):
Cl2+H2O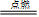 HCl + HClO
HCl + HClO
10.次氯酸溶液见光:
2HClO 2HCl + O2↑
2HCl + O2↑
11.氯气使湿润的碘化钾淀粉试纸变蓝:
Cl2+2KI = 2KCl + I2
12.工业制漂白粉:
2Ca(OH)2+2Cl2= CaCl2+Ca(ClO)2+2H2O
离子方程式:Ca(OH)2+Cl2= Ca2++Cl-+ClO-+H2O
13.漂白粉使用原理:
Ca(ClO)2+CO2+H2O = CaCO3↓+ 2HClO
14.向漂白粉溶液中通入足量SO2气体:
Ca(ClO)2+2SO2+2H2O=CaSO4↓+2HCl+H2SO4
离子方程式:Ca2++2ClO-+2SO2+H2O = CaSO4↓+SO42-+Cl-+4H+
15.漂白粉固体久置变质:
①Ca(ClO)2+CO2+H2O = CaCO3+2HClO;②2HClO 2HCl + O2↑
2HCl + O2↑
16.实验室制氯气:
⑴4HCl(浓)+MnO2 MnCl2+Cl2↑+ 2H2O(这是最常用的);
MnCl2+Cl2↑+ 2H2O(这是最常用的);
⑵2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
⑶KClO3+6HCl = KCl + 3Cl2↑+ 3H2O
⑷KClO+2HCl=KCl+Cl2↑+H2O
17.工业制氯气(氯碱工业):
2NaCl + 2H2O Cl2↑+ H2↑+ 2NaOH
Cl2↑+ H2↑+ 2NaOH
18.实验室制氯气时尾气吸收(制84消毒液):
Cl2+2NaOH = NaCl + NaClO + H2O
19.氯气溶于热浓碱溶液:
3Cl2+6KOH 5KCl +KClO3+3H2O
5KCl +KClO3+3H2O
20.氯化钾与氯酸钾在酸性条件下生成氯气:
5KCl +KClO3+3H2SO4= 3K2SO4+3Cl2↑+3H2O
21.氯酸钾与盐酸生成氯气:
6HCl +KClO3= KCl +3Cl2↑+3H2O
22.氯离子检验:
Cl-+Ag+=AgCl↓(白色沉淀不溶于硝酸)
23.溴离子检验:
Br-+Ag+=AgBr↓(浅黄色沉淀不溶于硝酸)
24.碘离子检验:
I-+Ag+=AgI↓(黄色沉淀不溶于硝酸)
25.氟气溶于水:
2F2+ 2H2O = 4HF +O2
26.氟与氢气反应:
F2+H2= 2HF
27.碘与氢气反应:
I2+H2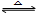 2HI
2HI
28.溴化银感光成像原理:
2AgBr 2Ag + Br2
2Ag + Br2
三、硫、硫酸
1.硫与铜共热:
2Cu + S Cu2S
Cu2S
2.硫与铁共热:
Fe + S FeS
FeS
3.硫与氢气反应:
H2+S H2S
H2S
4.硫在氧气中燃烧:
S + O2 SO2
SO2
5.硫与氢氧化钾溶液反应:
3S + 6KOH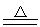 2K2S + K2SO3+3H2O
2K2S + K2SO3+3H2O
6.同元素的两种盐溶液遇酸生成该元素单质:
2K2S+K2SO3+3H2SO4= 3S↓+3K2SO4+3H2O
7.硫化氢燃烧(O2不足):
2H2S + O2 2S + 2H2O;
2S + 2H2O;
(O2充足):2H2S + 3O2 2SO2+2H2O
2SO2+2H2O
8.氢硫酸露置在空气中变浊:
2H2S + O2= 2S↓+ 2H2O
9.硫化氢隔绝空气加热:
H2S H2+S
H2+S
10.硫化氢与卤单质X2(Cl2、Br2、I2)反应:
H2S +X2= S↓+ 2HX
11.硫化氢气体通入硫酸铜溶液:
H2S + CuSO4= CuS↓+ H2SO4
12.硫化氢与二氧化硫气体混合:
2H2S + SO2= 3S↓+ 2H2O
13.硫化氢气体不能用浓硫酸干燥:
H2S + H2SO4(浓)=S↓+ SO2+2H2O
14.二氧化硫气体溶于水:
SO2+H2O H2SO3
H2SO3
15.实验室制二氧化硫气体:
Na2SO3+H2SO4= Na2SO4+SO2↑+ H2O
16.实验室用碱液吸收硫化氢:
H2S(少量)+2NaOH=Na2S + 2H2O;
H2S(过量)+NaOH=NaHS+ H2O
17.实验室用碱液吸收二氧化硫:
SO2(少量)+2NaOH=Na2SO3+H2O;
SO2(过量)+NaOH=NaHSO3
18.纯碱溶液吸收少量二氧化硫:
SO2(少量)+2Na2CO3+H2O = Na2SO3+2NaHCO3
纯碱溶液1:1吸收二氧化硫:
SO2+Na2CO3= Na2SO3+CO2
纯碱溶液吸收过量二氧化硫:
2SO2+Na2CO3+H2O = 2NaHSO3+CO2
19.硫酸工业用氨水吸收二氧化硫及循环使用:
①SO2+2NH3·H2O = (NH4)2SO3+H2O;
②(NH4)2SO3+H2SO4= (NH4)2SO4+H2O + SO2↑
20.二氧化硫通入氯水(SO2与Cl2混合失去漂白性):
SO2+Cl2+2H2O = H2SO4+2HCl
21.二氧化硫通入溴水(SO2使溴水褪色):
SO2+Br2+2H2O = H2SO4+2HBr
22.二氧化硫使酸性高锰酸钾溶液褪色:
5SO2+2KMnO4+2H2O = 2H2SO4+K2SO4+2MnsO4
23.二氧化硫与稀硝酸:
3SO2+2HNO3(稀)+2H2O =3H2SO4+2NO
24.亚硫酸钠与稀硝酸:
3Na2SO3+2HNO3= 3Na2SO4+2NO↑+ H2O
25.亚硫酸钠溶液与卤单质X2(Cl2、Br2、I2)反应:
Na2SO3+X2+H2O = Na2SO4+2HX
26.亚硫酸盐放在空气中变质:
2Na2SO3+O2= 2Na2SO4
27.二氧化硫与二氧化氮气体不共存:
SO2+NO2= SO3+NO
28.浓硫酸与铜反应:
Cu +2H2SO4(浓) CuSO4+SO2↑+ 2H2O
CuSO4+SO2↑+ 2H2O
29.浓硫酸与碳反应:
C + 2H2SO4(浓) CO2↑+ 2SO2↑+ 2H2O
CO2↑+ 2SO2↑+ 2H2O
30.浓硫酸与硫共热:
S+ 2H2SO4(浓) 3SO2↑+ 2H2O
3SO2↑+ 2H2O
31.工业制硫酸:
①4FeS2+11O2 2Fe2O3+8SO2;也可以是S + O2
2Fe2O3+8SO2;也可以是S + O2 SO2);
SO2);
②2SO2+O2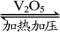 2SO3;
2SO3;
③SO3+H2O = H2SO4
32.氧气与臭氧互相转化:
3O2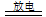 2O3;
2O3;
2O3 3O2
3O2
33.臭氧使碘化钾淀粉试纸变蓝:
O3+2KI + H2O = I2+2KOH + O2
34.双氧水与硫化氢:
H2S + H2O2= S↓+ 2H2O
35.双氧水与二氧化硫:
SO2+H2O2= H2SO4
36.双氧水与亚硫酸钠溶液:
Na2SO3+H2O2= Na2SO4+H2O
37.双氧水与高锰酸钾酸性溶液反应:
2KMnO4+5H2O2+3H2SO4= K2SO4+2MnSO4+5O2↑+ 8H2O
38.双氧水与氯气:
H2O2+Cl2=2HCl + O2
39.双氧水催化分解(实验室制氧气之一):
2H2O2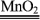 2H2O + O2↑
2H2O + O2↑
40.氯酸钾催化加热分解(实验室制氧气之二):
2KClO3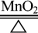 2KCl + 3O2↑
2KCl + 3O2↑
41.高锰酸钾加热分解(实验室制氧气之三):
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
42.硫酸酸雨形成过程:
SO2+H2O H2SO3 ,2H2SO3+O2=2H2SO4
H2SO3 ,2H2SO3+O2=2H2SO4
43.硫代硫酸盐在酸性条件下自身氧化还原:
Na2S2O3+H2SO4== Na2SO4+SO2↑+ S↓+ H2O
44.钙基固硫(煤的脱硫)消除二氧化硫污染:
①CaO + SO2 CaSO3;
CaSO3;
②2CaSO3+O2 2CaSO4
2CaSO4
四、氮和磷
1.工业合成氨:N2+3H2 2NH3
2NH3
2.二氧化氮自身二聚:2NO2(棕色) N2O4(无色)
N2O4(无色)
3.自然界形成硝酸酸雨(雷雨发庄稼):
①氮气与氧气放电N2+O2 2NO;
2NO;
②一氧化氮被氧气氧化:2NO + O2= 2NO2;
③二氧化氮溶于水:3NO2+H2O = 2HNO3+NO
4.工业制硝酸:
①4NH3+5O2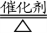 4NO + 6H2O;②2NO + O2= 2NO2;③3NO2+H2O = 2HNO3+NO
4NO + 6H2O;②2NO + O2= 2NO2;③3NO2+H2O = 2HNO3+NO
5.镁在氮气中燃烧:3Mg + N2 Mg3N2
Mg3N2
6.氮化镁投入水中:
Mg3N2+6H2O = 3Mg(OH)2+2NH3↑
7.氮化镁与盐酸反应生成两种盐:
Mg3N2+8HCl = 3MgCl2+2NH4Cl
8.氨气溶于水显碱性:
NH3+H2O NH3·H2O
NH3·H2O NH4++ OH-
NH4++ OH-
9.氨气与氯化氢的“白烟”实验:
NH3+HCl = NH4Cl
10.氨气的催化氧化:
4NH3+5O2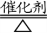 4NO + 6H2O
4NO + 6H2O
11.工业制硝酸中尾气中NO2与NO共同与碱液反应:
NO2+NO + 2NaOH = 2NaNO2+H2O
12.二氧化氮与氢氧化钠溶液反应:
2NO2+2NaOH = NaNO2+NaNO3+H2O
13.氨气与氯气反应:
2NH3(少量)+3Cl2= N2+6HCl;8NH3(足量)+3Cl2= N2+6NH4Cl
14.氯化铵受热:NH4Cl NH3↑+ HCl↑
NH3↑+ HCl↑
15.碳酸氢铵分解:
NH4HCO3 NH3↑+ H2O + CO2↑
NH3↑+ H2O + CO2↑
16.实验室制氨气(常用碱石灰与氯化铵):
2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2+2H2O
2NH3↑+ CaCl2+2H2O
17.浓硝酸常显黄色原因:
4HNO3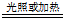 4NO2↑+ 2H2O + O2↑
4NO2↑+ 2H2O + O2↑
18.铜与浓硝酸(实验室制NO2):
Cu + 4HNO3(浓)=Cu(NO3)2+2NO2↑+ 2H2O
19.铜与稀硝酸:
3Cu +8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
20.银与稀硝酸:
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
21.少量铁与稀硝酸:
Fe + 4HNO3(稀)=Fe(NO3)3+NO↑+ 2H2O
22.过量铁与稀硝酸:
3Fe + 8HNO3(稀)=3Fe(NO3)2+2NO↑+ 4H2O
23.浓硝酸与磷共热:
P + 5HNO3(浓) H3PO4+5NO2↑+ H2O
H3PO4+5NO2↑+ H2O
24.浓硝酸与硫共热:
S + 6HNO3(浓) 2H2SO4 + 6NO2↑ + 2H2O
2H2SO4 + 6NO2↑ + 2H2O
25.浓硝酸与碳共热:
C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O
CO2↑+ 4NO2↑+ 2H2O
26.工业用磷矿石制普钙:
Ca3(PO4)2+2H2SO4(浓)=2CaSO4+Ca(H2PO4)2
27.工业用磷矿石制重钙:
Ca3(PO4)2+4H3PO4== 3Ca(H2PO4)2
28.工业用磷矿石制磷酸:
Ca3(PO4)2+3H2SO4(浓)=3CaSO4+2H3PO4
29.五氧化二磷与热水反应:
P2O5+3H2O 2H3PO4
2H3PO4
30.五氧化二磷与冷水反应:
P2O5+H2O= 2HPO3
五、碳和硅
1.工业制二氧化碳:
CaCO3 CaO + CO2↑
CaO + CO2↑
2.硅的燃烧:
Si + O2 SiO2
SiO2
3.工业制粗硅:
SiO2+2C Si + 2CO↑
Si + 2CO↑
4.粗硅精制:
①Si + 2Cl2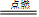 Si + 4HCl
Si + 4HCl
②SiCl4 + 2H2 Si + 4HCl
Si + 4HCl
5.制金刚砂:
SiO2+3C SiC + 2CO↑
SiC + 2CO↑
6.硅与氢氧化钠溶液反应:
Si + 2NaOH + H2O = Na2SiO3+2H2↑
7.硅与氢氟酸反应:
Si + 4HF = SiF4↑+ 2H2↑
8.二氧化硅与氢氧化钠溶液反应(强碱腐蚀玻璃):
SiO2+2NaOH = Na2SiO3+H2O
9.氢氟酸雕刻(腐蚀)玻璃:
SiO2+4HF = SiF4↑+ 2H2O
10.工业制玻璃:
SiO2+Na2CO3 Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
11.硅酸钠溶液中通二氧化碳气体:
Na2SiO3+CO2+H2O = H2SiO3(胶体)+ Na2CO3
12.硅酸钠溶液中加入盐酸:
Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
13.硅酸钠溶液与铵盐混合:
Na2SiO3+2NH4Cl + 2H2O = H2SiO3↓+ 2NaCl + 2NH3·H2O
14.工业制氢气:
①C + H2O CO + H2,
CO + H2,
②CO + H2O CO2+H2
CO2+H2
15.工业制水煤气(煤的气化):
C + H2O CO + H2
CO + H2
16.草酸使高锰酸钾溶液褪色:
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+ 8H2O
六、镁、铝、铁
1.镁与水反应:Mg + 2H2O Mg(OH)2+H2↑
Mg(OH)2+H2↑
2.镁在二氧化碳中燃烧:2Mg + CO2 2MgO + C
2MgO + C
3.镁与氯化铵等水解显酸性的盐溶液反应:
Mg + 2NH4Cl = MgCl2+2NH3↑+ H2↑
镁与氯化铜等水解显酸性的盐溶液反应:
Mg + CuCl2+2H2O= MgCl2+Cu (OH)2↓+H2↑
4.氢氧化镁溶于氯化铵溶液:
Mg(OH)2+2NH4Cl = MgCl2+2NH3·H2O
5.铝与盐酸:
2Al + 6HCl = 2AlCl3+3H2↑
6.铝与氢氧化钠溶液:
2Al + 2NaOH + 2H2O = 2NaAlO2+3H2↑
7.铝与氧化铁(铝热反应之一):
2Al + Fe2O3 Al2O3+2Fe
Al2O3+2Fe
8.氧化铝溶于盐酸中:
Al2O3+6HCl = 2AlCl3+3H2O
9.氧化铝溶于氢氧化钠溶液中:
Al2O3+2NaOH = 2NaAlO2+H2O
10.氢氧化铝溶于盐酸中:
Al(OH)3+3HCl=AlCl3+3H2O
11.氢氧化铝溶于氢氧化钠溶液中:
Al(OH)3+NaOH=NaAlO2+2H2O
12.氢氧化铝的两种电离方式:
Al3++ 3OH- Al(OH)3
Al(OH)3 H++ AlO2-+ H2O
H++ AlO2-+ H2O
13.向氯化铝溶液中加入少量氢氧化钠溶液:
AlCl3+3NaOH = Al(OH)3↓+ 3NaCl
14.向氯化铝溶液中加入过量氢氧化钠溶液:
AlCl3+4NaOH = NaAlO2+3NaCl + 2H2O
15.向偏铝酸钠溶液中加入少量盐酸:
NaAlO2+HCl + H2O = Al(OH)3↓+ NaCl
16.向偏铝酸钠溶液中加入过量盐酸:
NaAlO2+4HCl = AlCl3+NaCl + 2H2O
17.向偏铝酸钠溶液中通入少量二氧化碳:
2NaAlO2+CO2+3H2O =2Al(OH)3↓+ Na2CO3
18.向偏铝酸钠溶液中通入过量二氧化碳:
NaAlO2+CO2+2H2O = Al(OH)3↓+ NaHCO3
19.偏铝酸钠溶液与氯化铝溶液:
3NaAlO2+AlCl3+6H2O = 4Al(OH)3↓+ 3NaCl
20.实验室制取Al(OH)3:
Al2(SO4)3+6NH3·H2O =2Al(OH)3↓+ 3(NH4)2SO4
21.工业生产铝(电解熔融的Al2O3):
2Al2O3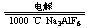 4Al + 3O2↑
4Al + 3O2↑
22.铁与硫共热:Fe + S FeS
FeS
23.铁在氧气中燃烧:
3Fe + 2O2 Fe3O4
Fe3O4
24.氯气与铁点燃:
2Fe + 3Cl2 2FeCl3
2FeCl3
25.碘与铁反应:
Fe + I2 FeI2
FeI2
26.铁与氯化铁溶液:
Fe + 2FeCl3= 3FeCl2
27.铁与高温水蒸汽反应:
3Fe + 4H2O(g) Fe3O4+4H2
Fe3O4+4H2
28.氯化铁溶液与铜:
Cu + 2FeCl3= CuCl2+2FeCl2
29.氯化铁溶液与硫化氢:
2FeCl3+H2S = 2FeCl2+S↓+ 2HCl
30.氯化铁溶液与碘化氢:
2FeCl3+2HI = 2FeCl2+I2+2HCl
31.氯化铁溶液与二氧化硫:
2FeCl3+SO2+2H2O = 2FeCl2+H2SO4+2HCl
32.氯化亚铁与氯气:
2FeCl2+Cl2= 2FeCl3
33.氯化亚铁酸性溶液与双氧水:
2FeCl2+2HCl + H2O2= 2FeCl3+2H2O
34.氯化亚铁溶液在空气中变质:
4FeCl2+O2+4HCl = 4FeCl3+2H2O
35.氯化亚铁与氢氧化钠溶液:
FeCl2+2NaOH = Fe(OH)2↓+ 2NaCl
36.氢氧化亚铁放空气中变色:
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
37.氯化亚铁与铁氰酸钾(亚铁离子检验):
3FeCl2+2K3[Fe(CN)6] =Fe3[Fe(CN)6]2↓(蓝色)+6KCl
38.氯化铁溶液与硫氰酸钾(铁离子检验):
FeCl3+3KSCN Fe(SCN)3(血红色溶液)+ 3KCl
Fe(SCN)3(血红色溶液)+ 3KCl
39.氯化铁溶液与氢氧化钠溶液(铁离子检验):
FeCl3+3NaOH = Fe(OH)3↓(红褐色沉淀)+ 3NaCl
40.除去氯化铜溶液中的氯化铁(沉淀转化):
2FeCl3+3Cu(OH)2=Fe(OH)3+3CuCl2
41.工业用氧化铁冶铁(与一氧化碳)反应:
Fe2O3+3CO 2Fe + 3CO2
2Fe + 3CO2
42.氧化铜与碳:
CuO + C Cu + CO↑;CuO + CO
Cu + CO↑;CuO + CO Cu + CO2
Cu + CO2
43.重铬酸钾的酸碱性转化:
K2Cr2O7+H2O K2CrO4+H2CrO4
K2CrO4+H2CrO4
离子方程式:Cr2O72-+ H2O CrO42-+ 2H+
CrO42-+ 2H+

- 全部评论(0)
