熵如何使不可能变为可能?
时间:2022-10-25 09:21 来源:未知 作者:化学自习室 点击: 次 所属专题: 熵判据
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我们都知道,熵是混乱度的量度,体系的微观粒子数越多、运动空间越大,熵值越大。孤立体系趋向于向熵增的方向自发进行。
我们都喜欢有序的世界,但是这是一个熵减的过程,需要我们做功来达成。例如,整理一个洁净的房间、努力做一个自律的好孩子。。。。。。
好像,熵就是一个调皮鬼,总是爱捣蛋、搞破坏,把体系弄得乱七八糟的。
但是,它也爱助人为乐哦。
一、热还原法制备单质
热还原法制备金属钾是在850℃ 用金属钠来还原 KCl 得到的。
KCl(l) + Na(l) === NaCl(l) + K(g)
但是,根据我们的常识,钠不如钾活泼为什么高温时氯化钾和钠反应能制备出钾单质和氯化钠呢?
首先,这个还原反应需要在高温、熔融的状态下反应,金属性活动顺序是相对于水溶液而言的,对于固体或者熔融状态的反应中并不适用。而且金属钠和钾都能与水反应,这个反应不可能在水中进行。
其次,钾和钠同属于ⅠA族元素,钠在第三周期,钾位于第四周期,同一主族从上到下金属的原子半径逐渐增大,熔沸点逐渐降低,Na 的沸点 882.9℃,K 的沸点 759℃,在反应温度 850℃时,钾是气态。因此,此反应属于熵增过程,自发进行的趋势较大;而且,气态钾能从体系中脱离出去,使反应向右进行。
第三,反应物 KCl 和产物 NaCl 都是离子晶体,离子半径 K+ > Na+,所以 KCl 的晶格能小,NaCl 的晶格能大,更稳定。
这就是熵的妙用——控制温度,利用熵增将不可能变为可能。
二、热力学耦合制备卤化物
硅、铝、钛等元素在自然界中往往以氧化物或含氧酸盐的形式存在。他们的氧化物的标准摩尔生成吉布斯自由能比氯化物的更低,也就是氧化物比氯化物更稳定。故以这些氧化物为原料制备卤化物的反应,在热力学上是不利的。
例如:


这就是熵的妙用——耦合一个自发反应使不可能成为可能。
现在我们遇到了一个问题,以碳的氧化反应耦合促进热力学不利的反应发生,为什么是生成CO 而不是生成 CO2 呢?
实际上焦炭是冶金工业的重要还原剂,通常被用来还原金属氧化物矿物以冶炼金属。
例如碳还原氧化锌制备金属锌。
以下哪个反应会发生呢?
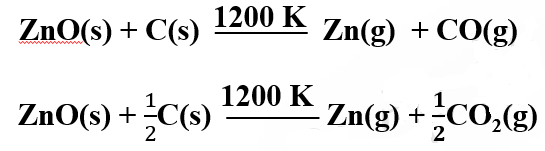
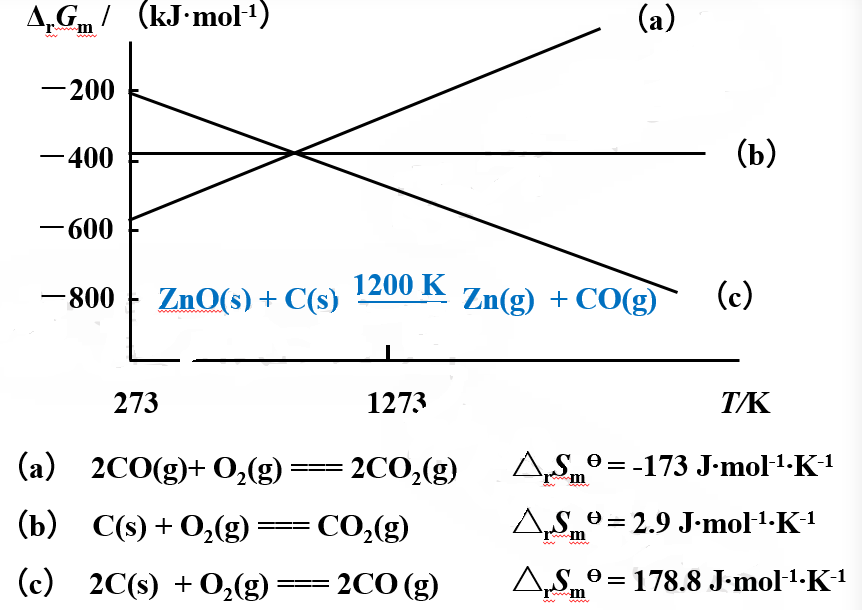
聪明的你已经猜到了吧:生成CO比生成CO2的过程熵增大。(为什么,见大中衔接 // 熵 )
由下图我们也很明显地能看出来,随着温度的升高,熵增最大的反应2C(s) + O2(g) === 2CO (g) 的吉布斯自由能变 越来越负,预示着反应的自发性越来越强,所以碳在高温下被氧化产物是CO。

- 全部评论(0)
