几类特殊的电极反应物
时间:2022-11-16 15:17 来源:未知 作者:化学自习室 点击: 次 所属专题: 电极反应式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
无论是原电池,还是电解池,这些装置的反应原理实质都是氧化还原反应。从这些装置的电极反应入手,借助于离子放电顺序来书写,再相加得出总反应。所谓的离子放电顺序,其实质就是这些离子的氧化性(或还原性)顺序,如电解池中,阳极(注:惰性阳极)上阴离子的被氧化顺序就是它们的还原性强弱顺序:S2->I->Br->Cl->OH->含氧酸根离子>F-;阴极上阳离子的被还原顺序就是它们的氧化性强弱顺序:Ag+>Fe3+>Cu2+>H+>Fe2+>Al3+>Mg2+>Na+>Ca2+>K+。
从上述一般规律的实质入手,结合实验事实,对于不常见的属于考查范围内的几类特殊电极反应物归纳如下,供读者拓展视野。
思考1:阴离子能在阴极上放电吗?
阴极发生得电子的还原反应,体现出放电离子的氧化性,一些阴离子的氧化性比较强,当条件合适时也可以在阴极放电。
典例1 离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的_____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为________。
答案:负 4Al2Cl7-+3e-===Al+7AlCl4- H2
解析:电镀时钢制品应作阴极,故应接电源的负极;目的是在钢制品上镀铝,故阴极有Al产生,根据电荷守恒写出阴极反应式为4Al2Cl7-+3e-===Al+7AlCl4-;若使用AlCl3水溶液,则是H+在阴极放电,产生H2。
[盲点点拨]很多具有氧化性的阴离子可以在电解池的阴极得电子发生还原反应,在高考题中需要特别关注NO3-、MnO4-、Cr2O72-等在特定环境下具有氧化性的阴离子。
思考2:阳离子能在阳极放电吗?
阳极发生失电子的氧化反应,本质是放电离子还原性的体现,某些处于较低价态阳离子具有较强的还原性,可以在阳极放电发生氧化反应。
典例2 铝及其化合物可用于蓄电池、耐酸设备及X-射线防护材料。回答下列问题:
PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为___________,
阴极上观察到的现象是_________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 _________,这样做的主要缺点是_____________。
答案:Pb2++2H2O-2e-===PbO2+4H+ 石墨上有红色物质析出 Pb2++2e-===Pb 不能有效利用Pb2+
解析:从实验目的来看应由Pb2+升高变为PbO2,阳极电极反应式为Pb2++2H2O-2e-===PbO2+4H+;阴极反应式为Cu2++2e-===Cu,故阴极石墨上有红色物质析出。只有Pb(NO3)2溶液时,阴极反应为Pb2++2e-===Pb,导致Pb2+的利用率降低(没有全部转化为产物PbO2)。
[盲点点拨] 阳离子可以在阳极放电,有些还原性较强的离子(如Fe2+)甚至可能先于阴离子反应。而这恰好是符合氧化还原反应规律的(还原性:Fe2+>Cl-)。
思考3:含氧酸根离子会参与电极反应吗?
典例3 制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
(1)阳极的电极反应式为__________________。
(2)电解后,________室的NaHSO3浓度增加。
(3)b室的_______(填“NaHSO3”或“Na2SO3”)浓度增加,原因是_____________________________ (用电极反应式说明)。
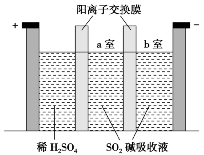
答案:(1)2H2O-4e-===O2↑+4H+ (2)a (3)Na2SO3 2HSO3-+2e-===H2↑+2SO32-
解析:(1)阳极区为H2SO4溶液,故阳极反应式为2H2O-4e-===O2↑+4H+。(2)电解后阳极区域产生的H+透过阳离子交换膜进入a室,发生反应SO32-+H+===HSO3-(SO32-结合H+能力比HSO3-强)使a室的NaHSO3浓度增加。(3)b室为阴极区,电极反应式为2HSO3-+2e-===H2↑+2SO32-(H+主要来自于HSO3-的电离),故b室的Na2SO3浓度增加。
[盲点点拨](3)中的阴极反应式非常特别,HSO3-参与电极反应,但却是其中的H元素价态发生了变化。发生电极反应时可能并不是中心元素的价态发生改变.
思考4:分子有可能参与电极反应吗?
典例4 电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_______________,说明理由:_______________。

答案: NH3 观察图示转化中应通入NH3,把多余的HNO3转变为NH4NO3
解析: 观察图示转化,结合电极反应的对应关系得出,阴极:NO+5e-+6H+===NH4++H2O;阳极:NO-3e-+2H2O===NO3-+4H+。总反应式为8NO+7H2O===3NH4NO3+2HNO3,故a中应通入NH3,把多余的HNO3转变为NH4NO3。
[盲点点拨] 当条件合适的情况下,电中性的分子也有可能参与电极反应。

- 全部评论(0)
