关于盐桥的一些疑惑分析
时间:2022-12-14 08:36 来源:未知 作者:王笃年 点击:次 所属专题: 盐桥
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.为什么要把单液电池发展为双液电池?
主要原因是单液电池不具有商品性。
试想,你把一个Zn-Cu-H2SO4单液电池摆在商店里待售,将是一种怎样的局面?
即使在外电路断开的状态下,只要一天里没有卖出,锌电极已经反应掉大半。电池尚未用来发电,电池材料已经消耗得差不多了,还能够卖出去吗?
双液电池就不同了,只要你不接通电路,待售期间它是基本不会损耗电池材料的。请对照双液电池示意图对此结论加以理解。
至于其它的一些“貌似合理”的解释,比如说“双液电池比单液电池的电压稳定”、“电流持久”等,只是理论分析的结果。
通过实际试验你可发现,构成材料接近的单液、双液两种电池一旦接通电路,除了双液电池输出电压略低于单液电池(盐桥的存在导致内阻变大),在其它方面二者并无很大差异。
2.盐桥中的电解质离子会不会耗尽?
不会。盐桥如果保存得当(不用时浸泡在浓度大的食盐水中),可做到连续多年使用。之所以发出“盐桥内的离子浓度会不会降低”疑问,源于众多教科书里对盐桥工作原理过于简单的解读——电池工作过程中,为平衡两极电荷,盐桥中的离子分别向两极输出。
其实,盐桥内的离子可以输出,两极溶液里的离子也会沿着电场规定方向进入盐桥。比如,铜锌双液电池,锌电极一侧因锌片的不断离子化,Zn2+浓度增大,它会向盐桥内扩散;同理,铜电极一侧由于Cu2+的不断还原,溶液里多余的SO42-也会沿着电场规定的方向向盐桥内移动。
“这样,盐桥内的离子岂不乱了?”的确,随着使用时间的延长,盐桥内不会再单纯是原来溶解在琼胶里的电解质了,但并不妨碍它起到平衡两极电势的作用。“乱了”又有什么关系呢?
3.盐桥里的电解质一定要用KCl吗?换别的电解质行不行?
根据上述对问题2的分析可知,盐桥内使用什么电解质,并没有严格的规定。
至于一些教科书里说什么“K+跟Cl-扩散速率差异小”之类的看似合理的解释,并没有什么科学道理。
这是因循了中国人的不良“传统”,大人对于孩子、老师对于学生提出的问题,必然要给出“合理”的解释,否则就显得大人与老师没有学问了。
当然,在实用性电池里,为了尽可能减小电池的内电阻,电解质的选择还是非常重要的。
4.用导线替代盐桥,电路中是否仍然会有电流?
试验的结果是,一般仍会有。
让我们以铜锌电池为例,将盐桥更换为铜导线,分析如下:
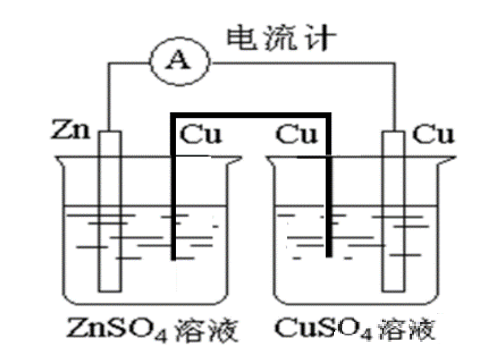
将盐桥更换为Cu导线后,整个装置的性质发生了改变。左侧成为一个新的铜锌原电池——以锌的吸氧腐蚀为基础反应,负极是Zn,发生Zn - 2e-= Zn2+的氧化反应;正极则发生O2+4e-+ 2H2O = 4OH-的还原反应。
而右侧则变为以铜为电极电解CuSO4溶液的电解池装置。左侧的铜为阳极,发生Cu - 2e-= Cu2+的氧化反应,右侧为阴极,发生Cu2++ 2e-= Cu的还原反应。
实测的电流方向,跟上述分析完全一致。
如果将盐桥更换为Zn导线呢?请大家自行画图分析。
5.为什么实用电池里没有看到盐桥?
的确,实用电池里并不存在盐桥,因为盐桥被电阻小得多的“离子交换膜”代替了。
请看如下两个装置。
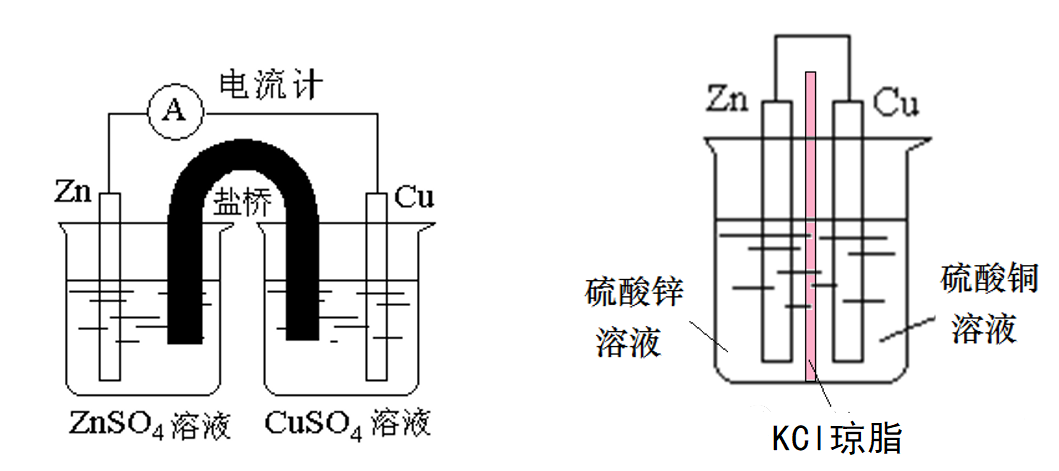
这俩装置中,电极材料、电解质溶液种类和浓度分别对应一致,唯一不同之处就是左侧使用常规的盐桥,而右侧只使用薄薄一层含KCl的琼胶(跟左侧盐桥内成分完全一致)分隔开阴阳两极。
根据物理学原理可知,左侧电池的内阻远大于右侧。这样,在电池电动势相同的情况下,左侧电池的输出电压就低于右侧。
人们当然不希望无谓地浪费电池的电动势了,所以就设法缩短“盐桥”、降低电池内阻。最终结果如何?
盐桥越来越薄,最终演变为离子交换膜。
早期的实用电池用的是强度较大的牛皮纸,现在逐步被各种有机合成材料薄膜替代了。这就是为什么我们在各种实用电池内看不到盐桥的原因。

- 全部评论(0)
