用平衡常数解释冰醋酸稀释时氢离子浓度的变化
时间:2023-01-10 10:33 来源:未知 作者:化学自习室 点击: 次 所属专题: 电离平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
弱电解质电离中的一个常见问题是:冰醋酸逐滴加水稀释,溶液中氢离子浓度的变化情况为何?只需想到不加水时或加无穷多水时溶液中氢离子浓度都很小(前者因为无水难电离,后者因为太稀了),答案就很简单了:先增大后减小。但这样的解释还是令人感觉不够满意:明明是一个连续的过程,为何要用两个理由来解释?能不能用一个一体化的方式来解释呢?
考虑醋酸的电离平衡完整形式:

在不太稀的溶液中,H2O的浓度可以看作定值,为55.41mol/L,不计入平衡常数表达式:
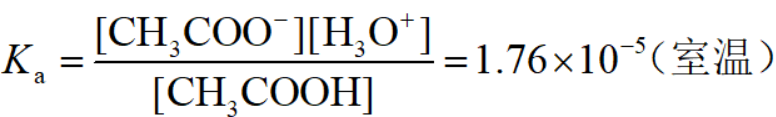
在很浓的溶液中,H2O的浓度不再是定值(原因见昨天的文章有点麻烦的平衡常数表达式),此时就需要使用列入了水的浓度的平衡常数表达式Ka':
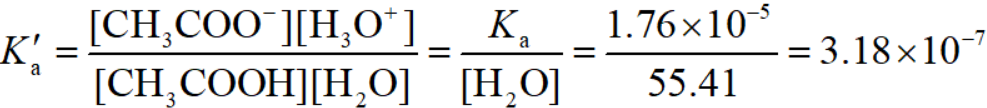
设从1.00mL冰醋酸出发加水稀释,计算加水VmL时溶液中的[H+]。
查表可知20°C下冰醋酸的密度为1.0477g/cm3,水的密度为0.9982g/cm3,两者相差不大,可近似认为混合时体积不发生变化,即V总≈ V醋+ V水。则可计算出混合后溶液中醋酸和水的浓度分别为:
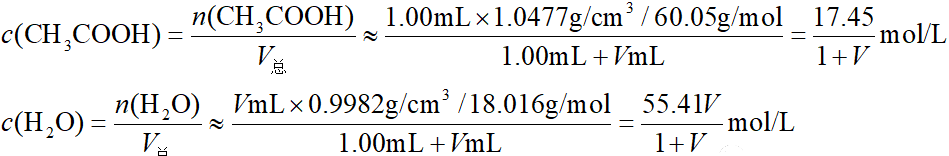
忽略水的电离,列出醋酸电离的三段式:
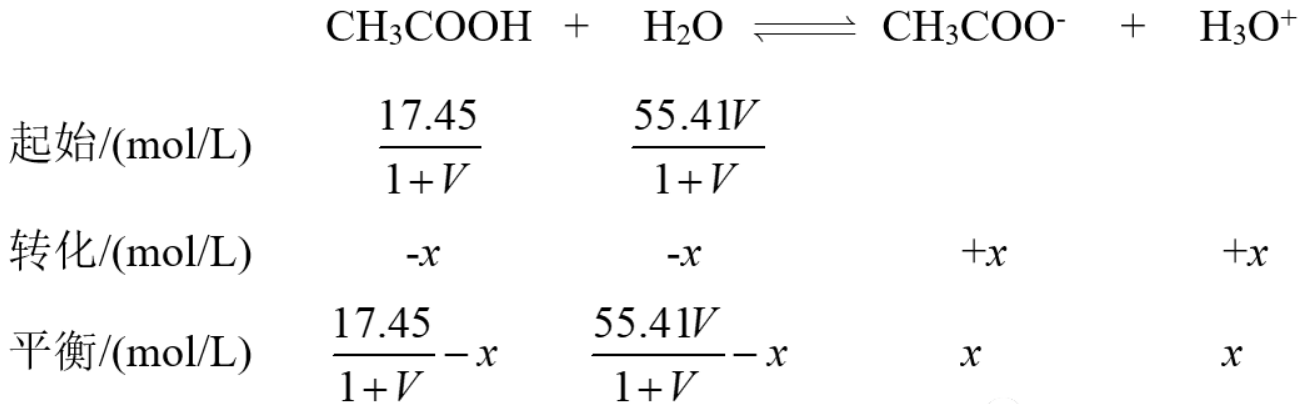
代入平衡常数表达式:
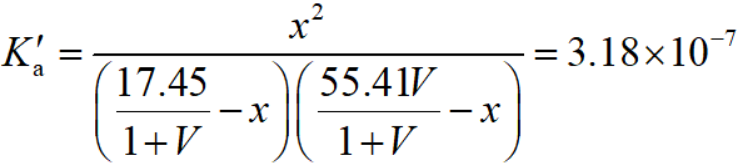
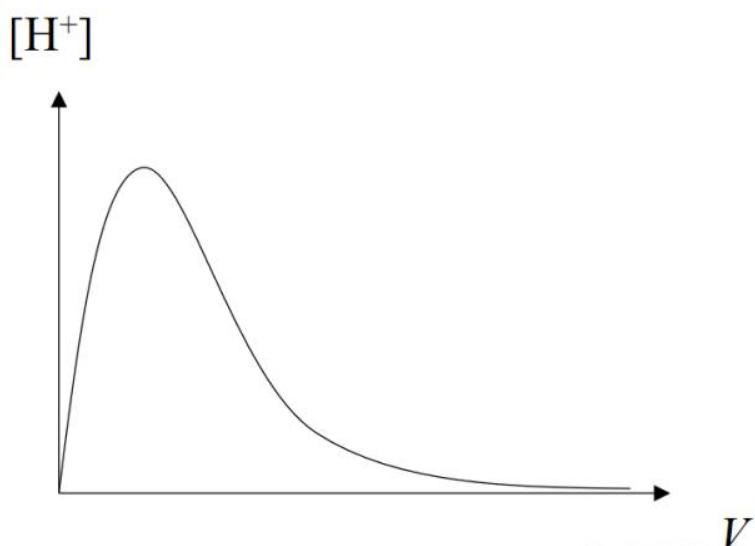
解出x即为[H+],绘制出[H+]~V图像如图:
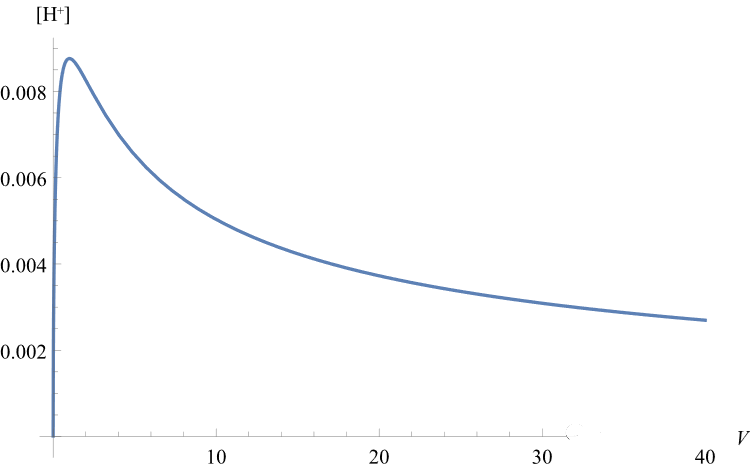
可见[H+]确实出现了先增大后减小的情况。
而如果使用不带水的浓度的Ka进行计算:
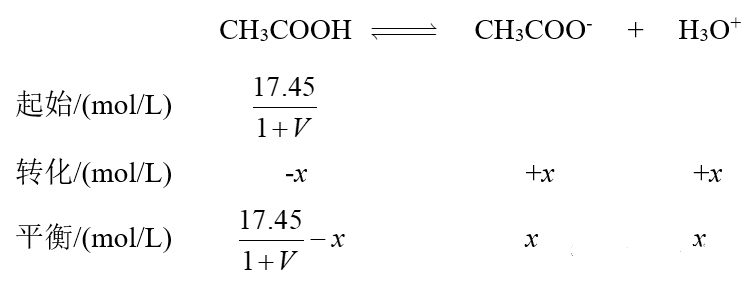
代入平衡常数表达式:

解出x即为假想的[H+]假,绘制出[H+]假~V图像(红线),与[H+]真~V图像(蓝线)对比如图:
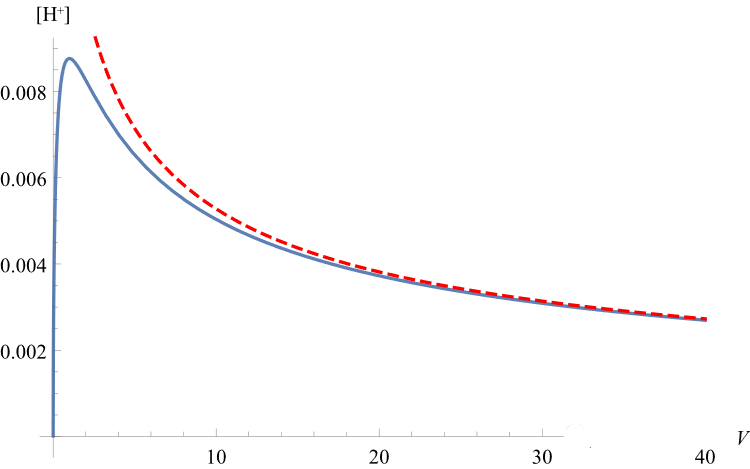
可见在加水体积较多的情况下,两者变化曲线趋于重合,即当溶液很稀时,Ka'退化为Ka。
类似的情况还有不少,比如蒸发浓缩硫酸铜溶液时,前期由于升温,水解平衡正向移动:
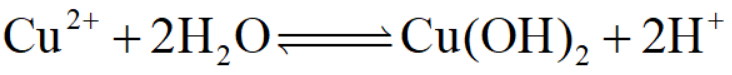
后期由于溶液浓度增大,反应物中的水的浓度需要计入平衡常数,平衡常数表达式变为:
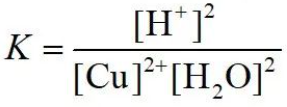
由于硫酸不易挥发,随着水越来越少,水的浓度也不断降低,Q>K,平衡左移,相当于硫酸和氢氧化铜又发生中和,最终析出了硫酸铜固体。
另外,严格地说,当粒子浓度很高时,应当用活度a而不是浓度c列入平衡常数表达式,不过这不影响本文讨论的结果。

- 全部评论(0)
