物质的用途及性质总结
时间:2023-08-13 07:59 来源:未知 作者:化学自习室 点击: 次 所属专题: 物质性质与用途
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、金属
1、钠
(2)Na燃烧不能用水灭,用干燥的沙土。Na、Mg的燃烧不用泡沫灭火剂灭火
(3)钠保存于煤油或石蜡里,金属锂只能存于石蜡中。钠的工业制备方法为电解熔融氯化钠。
(4)钠可用做电光源,制作高压钠灯。
(5)钠盐食品添加剂:
①食盐为NaCl,主要来源于海水
②味精为谷氨酸钠
③腌制食品里防腐剂为亚硝酸钠
(6)Na2O2强氧化剂,呼吸面具,潜水艇的供氧剂,其为过氧化物,不是碱性氧化物。
(7)Na2CO3俗称为苏打、纯碱,用于制玻璃,制皂,造纸,纺织;
(8)热碱去油污,碱指的Na2CO3,是加热可以增强去油污能力原因:碳酸根水解产生氢氧根,加热使平衡正向进行,氢氧根浓度上升,去油污能力增强。
(9)NaHCO3俗称小苏打,用于发酵粉, 制药,灭火剂。
制药,灭火剂。
(10)泡沫灭火器原理为硫酸铝和碳酸氢钠反应,离子反应方程式为:
![]()
(11)五彩缤纷的烟花是碱金属、锶、钡等金属化合物焰色反应所呈现的各种艳丽色彩;
(12)焰色试验属于物理变化,是检验金属元素的方法,其中检验K需要蓝色钴玻璃,它的作用滤去黄光
(13)铷、铯制光电管
(14)泡沫灭火器中主要是碳酸氢钠和硫酸铝溶液,两者混合时发生双水解反应,生成大量的二氧化碳泡沫,该泡沫能进行灭火,但是,喷出的二氧化碳气体泡沫中含有水,形成电解质溶液,具有一定的导电能力,可能导致触电或电器短路
2、镁铝
(1)铝可以用于制造铝合金汽车、船舶、飞机制造、防锈、油漆、导线、电缆
(2)镁可以用于制造飞机、照明弹
(3)铝制品使用广泛,因为其表面易形成稳定致密的氧化膜,在空气中稳定存在。但天然形成的氧化膜很薄,耐磨性和抗蚀性不够强,酸、碱、盐可直接侵蚀铝的保护膜及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
(4)铝热反应为某些金属氧化物粉末,与铝粉混合后在较高温度下剧烈反应生成Al2O3和其它金属并放出大量的热的反应
(5)能作铝热剂的不只是Fe2O3,还可以是V2O5、Cr2O3、MnO2等与Al粉形成铝热剂
(6)铝热反应较多的应用于生产上,如:焊接钢轨,熔炼难熔金属V、Cr等
(7)Al2O3冶炼金属铝的原料,高温耐火材料,实验室坩埚等耐高温的实验仪器;MgO高温耐火材料。
(8)Al2O3是红宝石、刚玉的主要成分。
(9)Al(OH)3、NaHCO3治疗胃酸过多
(10)镁离子被人体吸收后对心血管及神经系统均有抑制作用
(11)Al(OH)3分解是吸热反应且分解后生成Al2O3和水蒸气是其作阻燃剂的主要原因
3、铁铜
(1)Fe3O4做磁铁,俗名磁性氧化铁,是磁铁矿的主要成分;Fe2O3红油漆涂料,俗名铁红,是赤铁矿的主要成分。
(2)FeCl3溶液可作为“腐蚀液”该制印刷电路板。原理是
![]()
(3)Na2FeO4具有强氧化性,能消毒杀菌
(4)Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水
(5)CuSO4溶液配制农药(铜盐都有毒,因为Cu2+能与蛋白质作用,使其变性,失去生理活性)。
(6)无水硫酸铜可作为实验室检验水蒸气的试剂,现象为白色晶体变为蓝色。
(7)硫酸铜晶体(CuSO4·5H2O)俗名胆矾或蓝矾
(8)CuO 在高温下分解:![]()
CuO为黑色而Cu2O为红色,氧化铜可作为铜盐的原料,氧化亚铜可作为制造玻璃、搪瓷的红色颜料。
(9)黄铜矿(CuFeS2)、斑 铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石[CuCO3·Cu(OH)2]
铜矿(Cu5FeS4)、辉铜矿(Cu2S)、孔雀石[CuCO3·Cu(OH)2]
(10)还原性铁粉具有较强还原性、可吸收空气、用于食品行业的“双吸剂”,延长食品保质期
(11)纳米铁粉除去污水中的Cu2+、Ag+、Hg2+,主要利用铁粉的还原性比较强,可以置换出金属铜、银、汞,不是通过物理吸附作用
(12)聚合硫酸铁![]() 是新型絮凝剂,溶于水可形成Fe(OH)3胶体,吸附水中悬浮的杂质
是新型絮凝剂,溶于水可形成Fe(OH)3胶体,吸附水中悬浮的杂质
(13)冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
(14)生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐,某种能耐受铜盐毒性的细菌能利用空气中的氧气氧化硫化铜矿石,从而把不溶性的硫化铜转化为可溶性的铜盐,因此,其可用于生物炼铜
4、合金
(1)合金:由两种或两种以上的金属单质 (或金属与非金属)熔合而成的具有金属特性的物质。与各成分的金属相比,其硬度大,熔点低。
(2)生铁和钢是含碳量不同的的两种铁合金。
(3)我国最早使用的合金是青铜。碳素钢为一种合金材料
(4)“长征六号”运载火箭箭体采用铝合金材料,是因为材料强度高具有高强度和耐高温、耐腐蚀、密度小
(5)飞船表面结构的铝合金具有高强、高韧的优点,从而满足外太空中恶劣的环境
5、金属的冶炼
(1)Pt、Au:物理法;
Hg、Ag:热分解法;
Zn、Fe、Sn、Pb、Cu:热还原法(如:铝热反应);
K、Ca、Na、Mg:电解熔融氯化物;
Al:电解熔融氧化铝(用冰晶石形成低熔点共熔物)
(2)火法炼铜:黄铜矿与氧气高温、湿法炼铜:铁与硫酸铜溶液
二、非金属
1、氢
(1)H2探空气球,氢氧焰,冶金,合成氨,高能无害燃料。
(2)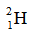 和
和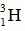 用于制造氢弹
用于制造氢弹
(3)利用放射性同位素释放的射线育种、治疗恶性肿瘤
2、碳和硅
(1)CO2灭火剂,制纯碱,制尿素,人工降雨(干冰)
(2)金刚石:制钻头;
(3)石墨:制电极,坩埚,铅笔芯,高温润滑剂
(4)木炭制黑火药;
(5)焦炭冶金;
(6)炭黑制油黑、颜料、橡胶耐磨添加剂
(7)硅是半导体材料,用于制作芯片,光电池(太阳能电池)是人造卫星,登月车,火星探测器,太阳能电动汽车的动力。光电池的原理是将太阳能直接转化为电能。
(8)半导体材料在周期表中金属与非金属的分解处。如Si、Ge、Ga。
(9)CaCO3:建筑石料,混凝土,炼铁熔剂,制水泥,制玻璃,制石灰
(10)SiO2:
①石英,水晶、玛瑙、沙子的主要成分
②纯净的SiO2是现代光学及光纤制品的基本原料(能够导光,不能够导电)
③因熔点高实验室做坩埚
④制石英玻璃、普通玻璃。
(11)硅胶做实验室食品药品干燥剂;催化剂载体
(12)Na2SiO3的水溶液俗称水玻璃是制备硅胶和木材防火剂原料
(13)SiO2透明度高,折射率合适,光能够发生全反射,故是制作光导纤维的主要原料
(14)利用CO2合成聚碳酸酯类可降解塑料,实现“碳”循环利用
(15)我国科学家利用赤泥和玉米秸秆制备的新型多孔生物炭具有强吸附性
(16)二氧化碳到淀粉的人工全合成技术,让化解粮食危机成为了可能
(17)活性炭可以通过吸附作用去除冰箱异味,但不能杀菌
(18)考古时利用146C测定文物的年代,中子数为8
(19)SiC俗称金刚砂,为原子晶体,硬度大,熔点高,耐磨性好,可用于制作高强度、耐高温、耐磨的产品,如高温结构陶瓷和轴承等
(20)敦煌壁画的颜料之一云母为聚硅酸盐,其阴离子以硅氧四面体为结构单元构成
(21)Na2SiO3俗称泡花碱
(22)碳酸气的主要成分为CO2
3、氯
(1)Cl2:自来水消毒,制盐酸,制漂白粉,制氯仿;是合成塑料、橡胶、人造纤维、农药、燃料、药品的重要原料
(2)氯水杀菌消毒的原因:反应生成HClO具有强氧化性
(3)使用氯气时自来水消毒,Cl2会与水中的有机物发生反应,生成有机氯化物,可能对人体有害,现试用新的自来水消毒剂,如:ClO2、O3
(4)漂白液、“84”消毒液的主要成份/有效成份:NaClO溶液
(5)漂白粉/漂白精的主要成份:Ca(ClO)2、CaCl2,有效成份:Ca(ClO)2
(6)漂白原理:
![]()
(7)漂白粉失效:
![]()
(见光易分解)
(8)漂白液、漂白粉可作棉、麻、纸张的漂白剂,也可作游泳池和环境的消毒剂
(9)消毒杀菌:
②皮肤消毒:高锰酸钾稀溶液、75%酒精、碘酒
③环境消毒:福尔马林(甲醛水溶液)
④苯酚粗品用于环境消毒,制洗剂,软膏用于皮肤消毒
(10)AgBr做感光材料;AgI作人工降雨
(11)氟氯代烷会破坏臭氧层,这是由于氟氯代烷在紫外线的照射下分解出氯原子,对臭氧变为氧气起催化作用
(12)溴的试剂瓶中加水,进行水封,保存液溴不能用橡胶塞。
(13)碘盐是食用盐中加入KIO3可防治甲状腺肿大
(14)HF是弱酸,能腐蚀玻璃,保存在铝制器皿或塑料瓶中
(15)含氟牙膏的原理:将腐蚀牙齿的羟基磷灰石转化为更难溶的氟磷灰石。且氟离子还能抑制口腔细菌产酸
(16)溴能与很多有机物发生取代反应和加成反应等从而形成溴代物,在药物合成方面有广泛应用
(17)萤石主要成分为CaF2
4、硫
(1)游离态的硫存在于火山口附近或地壳岩层里
(2)硫铁矿FeS2、黄铜矿 CuFeS2、生石膏CaSO4·2H2O、芒硝Na2SO4·10H2O 。
(3)黑火药:一硫、二硝、三木炭
![]()
(4)SO2漂白纸浆、毛、丝、草帽辫,生成不稳定的无色物质,日久恢复。SO2还用于杀菌、消毒。且是葡萄酒的辅助剂。
(5)SO2有毒不用于食品增白,会对人体的肝、肾脏等有严重损害,并有致癌作用
(6)医疗钡餐用硫酸钡。
(7)浓硫酸有吸水性:常用作干燥剂,但不能干燥还原性气体NH3、H2S、HBr、HI。
(8)水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去。
(9)臭氧为淡蓝色气体,刺激性特殊臭味。有极强氧化性—作消毒剂和脱色剂
(10)过氧化氢为绿色氧化剂,可以作为氧化剂、消毒剂、漂白剂、脱氯剂
(11)具有还原性,并且可以杀菌、消毒,在葡萄酒中添加适量的能杀灭微生物并防止葡萄酒的氧化变质
(12)硫化铜、硫化汞是难溶于水,加入硫化钠作沉淀剂,S2-与Cu2+和Hg2+容易结合成CuS沉淀、HgS沉淀,即,从而降低废水中Cu2+和Hg2+的浓度,与Na2S具有还原性无关
5、氮
(1)火箭使用偏二甲肼作燃料,燃烧放出巨大的能量,把火箭送入太空
(2)在闪电或行驶的汽车引擎中会发生反应:
![]()
(3)氮气的用途:
①合成氨,制硝酸;
②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
③在灯泡中填充氮气以防止钨丝被氧化或挥发;
④保存粮食、水果等食品,以防止腐烂;
⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
(4)氮的固定:游离态氮转变为化合态氮的方法。
①自然固氮 → 闪电时,N2转化为NO
②生物固氮 → 豆科作物根瘤菌将N2转化为化合态氮
③工业固氮 → 工业上用N2和H2合成氨气
(5)氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。
(6)氨气的用途:
①是氮肥工业及制造硝酸、铵盐、纯碱的原料;
②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;
③用作冰机中的致冷剂。
(7)王水是浓硝酸和浓盐酸体积比1:3的混合液,能溶解金、铂
(8)常温下可用铁、铝制容器盛装冷的浓硝酸和浓硫酸
(9)氮肥:氨态氮肥、硝态氮肥。贮存铵态氮肥时,为了防止受热分解,应密封包装并放在阴凉通风处;施用氮肥时应埋在土下并及时灌水,以保证肥效
(10)大空望远镜工作的推进剂为N2H4和N2O
6、稀有气体用途
(1)保护气,霓虹灯,激光
(2)装修材料的黏合剂中含有甲醛,天然大理石中含有放射性元素氡
(3)氦的相对分子质量很小,分子间作用力很弱,其沸点极低,可作制冷剂

- 全部评论(0)
