怎样判断电解质的强弱
时间:2016-02-02 21:34 来源: 作者:刘明 点击: 次 所属专题: 弱电解质判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
溶解于水或熔融状态下能导电的化合物是电解质。此定义可以分解为三要素:①熔化或者溶解。②能导电。③化合物。但在判断电解质的强弱时,没有明确指出具有极性键的共价化合物,哪些是强电解质,哪些是弱电解质。究竟强弱电解质有哪些判断依据呢?
一般来讲强弱电解质可以从如下三个方面来判断:①电离程度。②化学键。③化合物属类。当这三个方面产生矛盾时,主要区分标准是电离程度,即完全电离的电解质是强电解质。部分电离的电解质是弱电解质。
从化学键和化合物的属类判别强弱电解质。
(1)具有离子键与强极性键的化合物是强电解质。(2)盐类、强碱、强酸是强电解质。(3)具有弱极性共价键的化合物是弱电解质。(4)弱酸弱碱是弱电解质。
应该注意:(1)BaSO4在水溶液中,由于溶解度极小而水溶液几乎不导电,而溶解的小部分BaSO4完全电离,且在熔融时导电。因此BaSO4是难溶的强电解质。(2)CO2、SO2、NH3溶解于水时,生成的H2CO3、H2SO3、NH3·H2O能导电,不能说CO2、SO2、NH3是电解质,只能说H2CO3、H2SO3、NH3·H2O是电解质,而且是弱电解质。(3)HF(氢氟酸)中含强极性键,它的水溶液由于氢键等因素而电离度较小,因此氟化氢是弱电解质。(4)导电性的强弱与强弱电解质的判断没有直接关系。因为浓度很稀的强电解质也可以是导电性很弱的,而一定浓度的弱电解质也可以导电性较强。即使是弱电解质,随浓度的变小,导电性也是改变的。图是冰醋酸加水稀释时导电性改变的图表:
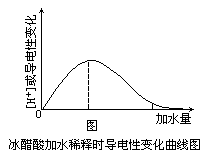
上图虚线段的醋酸溶液导电性最强,约为2 mol/L 的浓度。
综上所述,强弱电解质并不能按物质的本质属性分类,主要的判断依据是,能否在水溶液中完全电离。
2.离子反应的特征
在反应中有离子参加的化学反应为离子反应。在中学一般仅限于在溶液中进行的反应。可以说离子反应是指水溶液中有电解质参加的一类化学反应。因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。离子反应的特点是向着减少某些离子的方向进行,反应速率较快,大部分离子反应有明显的现象。
离子反应发生的条件是:
① 复分解反应:生成难溶物;生成难电离物;生成挥发性物质。
② 溶液中进行的某些氧化还原反应:有离子参加的置换反应;特殊氧化还原反应;在溶液中进行的电解反应。

- 全部评论(0)
